NRR:中国华南师范大学龙程/杨莉课题组提出谷氨酸能神经元中去泛素化酶CYLD能调控小鼠声音恐惧记忆的表达
撰文:李惠冬
审阅:龙程
恐惧是一种跨物种保守的情绪。适度的恐惧记忆有利于动物生存,恐惧记忆异常是恐惧症、创伤后应激障碍、惊恐障碍及广泛性焦虑症等神经精神疾病的重要病理表现[1]。基底外侧杏仁核是公认的声音恐惧记忆形成和巩固的关键脑区[2]。去泛素化酶Cylindromatosis(CYLD)高表达于免疫细胞,大量在非神经元中的研究表明CYLD是核转录因子κB信号通路的负调控因子[3]。BioGPS数据库(www.biogps.org)显示,CYLD在纹状体、伏隔核及杏仁核等脑区表达丰富,是啮齿类动物突触后致密部的重要成分[4]。CYLD在神经元中的生物学意义鲜为人知,但近年有研究关注到CYLD在情绪和学习记忆中的重要作用[5-8],中国华南师范大学生命科学学院龙程教授课题组和广州大学生命科学学院杨莉教授团队早期研究的成果已证明,CYLD在小鼠恐惧记忆中起调控的角色[9]。然而,已发表的关于神经元CYLD作用的研究成果都是在Cyld基因全身敲除小鼠模型(Cyld-/-)或培养的神经元/细胞系上获得的,缺乏神经元类型特异性敲除CYLD的研究。谷氨酸能神经元CYLD在神经元活动和恐惧记忆中的作用尚不清楚,亟待研究。
龙程/杨莉等合作在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Glutamatergic CYLD deletion leads to aberrant excitatory activity in the basolateral amygdala: association with enhanced cued fear expression ”的研究。文章发现,基底外侧杏仁核CYLD参与了声音恐惧记忆信息处理过程,特异性敲除谷氨酸能神经元CYLD增强了雄性小鼠的声音恐惧记忆表达。谷氨酸能神经元CYLD缺失小鼠的恐惧记忆异常可能与基底外侧杏仁核神经元激活程度增加、兴奋性突触传递受损、谷氨酸受体表达水平改变及小胶质细胞过度激活有关。研究结果提示,CYLD为恐惧记忆相关蛋白,研究CYLD在脑内的生物学功能将为揭示情绪/恐惧记忆相关的疾病如创伤后应激障碍等的发病机制及干预治疗提供新思路。
龙程/杨莉等既往研究表明,Cyld-/-小鼠杏仁核依赖的声音恐惧记忆表达受损,伴随着基底外侧杏仁核神经元激活程度下降、锥体神经元兴奋性降低及锥体神经元突触传递活动损害,提示CYLD在小鼠恐惧记忆及基底外侧杏仁核锥体神经元活动中的重要调控作用[9]。为观察经历恐惧训练及声音恐惧记忆测试后的小鼠基底外侧杏仁核CYLD水平是否发生变化,实验将C57BL/6小鼠分为2组:一组小鼠接受含5次条件刺激(声音)-非条件刺激(足部电击)配对的恐惧训练,24 h后接受声音恐惧记忆测试;另一组小鼠接受含5次条件刺激(不同时给予非条件刺激)的恐惧训练,同样在24 h后接受声音恐惧记忆测试。结果显示,5次条件刺激-非条件刺激配对恐惧训练可使恐惧记忆测试组小鼠成功建立并表达了声音恐惧记忆(图1)。声音恐惧记忆提取测试24 h后,恐惧记忆测试组小鼠基底外侧杏仁核CYLD蛋白水平下降(图1),表明基底外侧杏仁核CYLD蛋白参与了小鼠声音恐惧记忆信息处理过程。
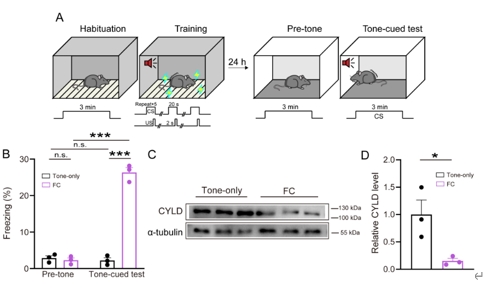
图1声音恐惧记忆提取24 h后C57BL/6小鼠基底外侧杏仁核CYLD蛋白水平下降(图源:Li et al., Neural Regen Res, 2025)
基底外侧杏仁核谷氨酸能神经元在声音恐惧记忆中起主导作用[10]。由于Cyld-/-小鼠全身所有细胞的CYLD被无选择性地敲除,无法确定在Cyld-/-小鼠中观察的声音恐惧记忆损害是否是由于谷氨酸能神经元缺失CYLD所致。为了回答这个问题,龙程/杨莉等将Vglut2Cre+/−小鼠与Cyldflox/flox小鼠杂交构建了特异性敲除谷氨酸能神经元CYLD的小鼠模型(Vglut2Cre+/− -Cyld flox/flox,简称cKO小鼠)。在验证CYLD蛋白敲除效率后,以Cyld flox/flox小鼠作为对照(简称WT小鼠),分别测试雌雄cKO和WT小鼠的恐惧记忆行为。结果显示,雌雄cKO小鼠经过恐惧训练后的僵直百分比与对照组相当(图2),表明谷氨酸能神经元CYLD缺失不影响小鼠的恐惧习得能力。和从Cyld-/-小鼠模型中获得的结果相似,雌雄cKO小鼠在场景恐惧测试期间的僵直百分比与对照组相比未发生改变(图2),表明cKO小鼠场景恐惧记忆表达无异常。有趣的是,在声音恐惧记忆测试中,雄性cKO小鼠的僵直百分比显著高于同窝WT小鼠,而雌性小鼠的僵直百分比与对照组相比无明显变化(图2),表明特异性敲除谷氨酸能神经元CYLD特异性导致了雄性cKO小鼠的声音恐惧记忆表达增强。于是在后续机制研究时只选用雄性cKO小鼠。
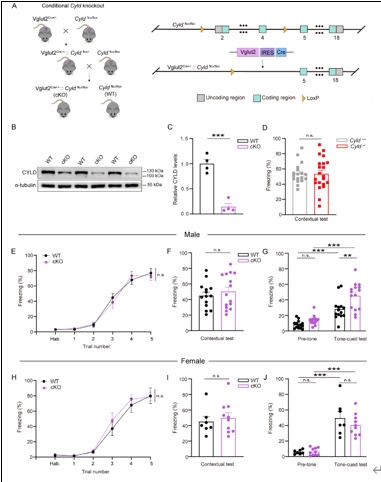
图2谷氨酸能神经元CYLD缺失特异性增强雄性小鼠声音恐惧记忆表达(图源:Li et al., Neural Regen Res, 2025)
在确认谷氨酸能神经元CYLD缺失对小鼠恐惧记忆的影响后,龙程/杨莉等进一步探究cKO小鼠声音恐惧记忆表达增强的可能机制。据报道基底外侧杏仁核神经元激活异常与声音恐惧记忆水平密切相关[11],因此采用神经元激活标志物c-Fos免疫荧光染色手段观察经历声音恐惧记忆测试90 min后小鼠杏仁核神经元的激活情况。结果显示,经历声音恐惧记忆测试后,cKO小鼠基底外侧杏仁核c-Fos+细胞数量增加(图3),表明声音恐惧记忆提取后基底外侧杏仁核神经元激活程度升高,这与cKO小鼠声音恐惧记忆表达增强的行为学结果一致。

图3 谷氨酸能神经元CYLD缺失增强小鼠基底外侧杏仁核神经元的激活(图源:Li et al., Neural Regen Res, 2025)
龙程/杨莉等接下来采用脑片膜片钳技术检测WT和cKO小鼠基底外侧杏仁核锥体神经元的突触传递活动。结果发现,cKO小鼠自发性兴奋性突触后电流的幅值和频率、微小兴奋性突触后电流的频率及微小抑制性突触后电流的幅值和频率均无异常,但微小兴奋性突触后电流的幅值下降(图4)。这些结果表明,谷氨酸能神经元CYLD缺失损害了基底外侧杏仁核的兴奋性突触传递。微小兴奋性突触后电流的幅值下降通常提示了突触后受体的含量可能发生了变化,因此进一步检测了cKO小鼠基底外侧杏仁核组织总蛋白中与恐惧记忆相关的AMPAR及NMDAR常见亚型(GluN1,GluN2B,GluA1和GluA2)的表达量。结果显示,cKO小鼠基底外侧杏仁核GluN1蛋白的表达水平下降,但GluN2B及GluA2的蛋白表达水平并无异常(图5)。有趣的是,cKO小鼠基底外侧杏仁核GluA1蛋白水平升高(图5)。这些结果表明,谷氨酸能神经元CYLD对于维持小鼠基底外侧杏仁核中AMPAR和NMDAR的正常水平至关重要,而AMPAR和NMDAR的正常水平对于维持适当的神经元活动和突触传递乃至恐惧表达有重要意义[2]。
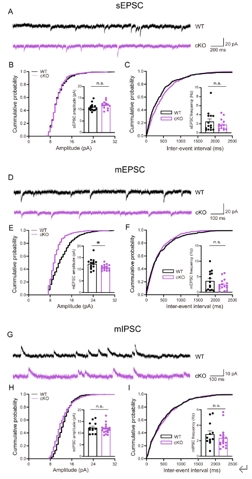
图4谷氨酸能神经元CYLD缺失损害小鼠基底外侧杏仁核兴奋性突触传递(图源:Li et al., Neural Regen Res, 2025)
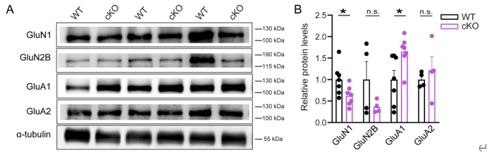
图5谷氨酸能神经元CYLD缺失影响小鼠基底外侧杏仁核GluN1及GluA1水平(图源:Li et al., Neural Regen Res, 2025)
突触的功能和发育很大程度受到神经-免疫相互作用的影响[12],研究指出激活的小胶质细胞与创伤后应激障碍相关的脑功能改变和行为改变(如恐惧记忆)以及焦虑症、抑郁症等密切相关[13]。龙程/杨莉等早期也揭示了CYLD在防止小胶质细胞过度激活和神经炎症方面的积极作用[5],因此接下来探究CYLD是否参与调节小胶质细胞活性,试图从不同角度寻找cKO小鼠恐惧记忆异常的可能机制。染色分析显示,cKO小鼠基底外侧杏仁核Iba-1+细胞分支总长度显著变短、Iba-1+细胞分支复杂度显著降低(图6);共染Iba-1和小胶质细胞激活标志物CD68、并用IMARIS软件三维重构对小胶质细胞发现,cKO小鼠基底外侧杏仁核单个小胶质细胞上CD68的点数及体积显著增加(图6)。这些结果表明,特异性敲除谷氨酸能神经元CYLD导致小鼠基底外侧杏仁核的小胶质细胞过度激活,CYLD对于维持小胶质细胞的生理活动非常重要。这可能与cKO小鼠声音恐惧记忆表达异常有关。
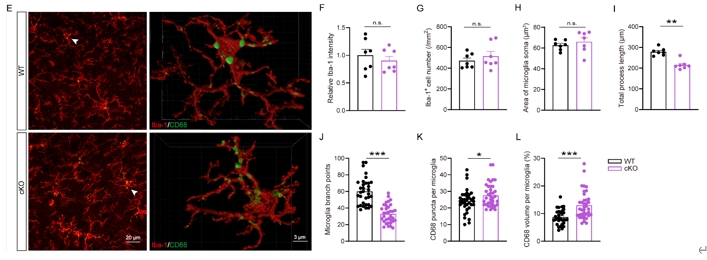
图6谷氨酸能神经元CYLD导致小鼠基底外侧杏仁核小胶质细胞过度激活(图源:Li et al., Neural Regen Res, 2025)
综上所述,该研究揭示了谷氨酸能神经元CYLD在声音恐惧表达中的作用和可能的机制。结果发现,谷氨酸能神经元中的CYLD对于维持基底外侧杏仁核中适度的神经元激活、突触传递、谷氨酸受体水平及小胶质细胞的生理功能状态至关重要,为揭示恐惧症及创伤后应激障碍等恐惧记忆相关疾病的发病机理及这些疾病的新药靶研究提供了新思路。然而,由于cKO小鼠全脑谷氨酸神经元的CYLD被无选择性地敲除,加之内侧前额叶皮质锥体神经元对声音恐惧记忆有关键的调控作用[14],该研究还无法排除内侧前额叶皮质锥体神经元CYLD缺失是否对cKO小鼠的声音恐惧记忆也产生了影响。特异性地敲除基底外侧杏仁核锥体神经元CYLD将助于更精细阐明基底外侧杏仁核锥体神经元CYLD对小鼠声音恐惧记忆的调控作用及机制;谷氨酸能神经元缺失CYLD后损伤信号如何传递给小胶质细胞并引起其过度激活的问题都有待进一步研究。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00054
参考文献
[1] Schmidt SD, Costa A, Rani B, et al. The role of carbonic anhydrases in extinction of contextual fear memory. Proc Natl Acad Sci U S A. 2020;117(27):16000-16008.
[2] Johansen JP, Cain CK, Ostroff LE, et al. Molecular mechanisms of fear learning and memory. Cell. 2011;147(3):509-524.
[3] Lork M, Verhelst K, Beyaert R. CYLD, A20 and OTULIN deubiquitinases in NF-κB signaling and cell death: so similar, yet so different. Cell Death Differ. 2017;24(7):1172-1183.
[4] Ma Q, Ruan H, Peng L, et al. Proteasome-independent polyubiquitin linkage regulates synapse scaffolding, efficacy, and plasticity. Proc Natl Acad Sci U S A. 2017;114(41):E8760-E8769.
[5] Han YY, Jin K, Pan QS, et al. Microglial activation in the dorsal striatum participates in anxiety-like behavior in Cyld knockout mice. Brain Behav Immun. 2020;89:326-338.
[6] Dobson-Stone C, Hallupp M, Shahheydari H, et al. CYLD is a causative gene for frontotemporal dementia - amyotrophic lateral sclerosis. Brain. 2020;143(3):783-799.
[7] Colombo E, Horta G, Roesler MK, et al. The K63 deubiquitinase CYLD modulates autism-like behaviors and hippocampal plasticity by regulating autophagy and mTOR signaling. Proc Natl Acad Sci U S A. 2021;118(47):e2110755118.
[8] Zajicek AS, Ruan H, Dai H, et al. Cylindromatosis drives synapse pruning and weakening by promoting macroautophagy through Akt-mTOR signaling. Mol Psychiatry. 2022;27(5):2414-2424.
[9] Li HD, Li DN, Yang L, et al. Deficiency of the CYLD impairs fear memory of mice and disrupts neuronal activity and synaptic transmission in the basolateral amygdala. Front Cell Neurosci. 2021;15:740165.
[10] Yiu AP, Mercaldo V, Yan C, et al. Neurons are recruited to a memory trace based on relative neuronal excitability immediately before training. Neuron. 2014;83(3):722-735.
[11] Sun XD, Chen WB, Sun D, et al. Neogenin in amygdala for neuronal activity and information processing. J Neurosci. 2018;38(44):9600-9613.
[12] Zajicek A, Yao WD. Remodeling without destruction: non-proteolytic ubiquitin chains in neural function and brain disorders. Mol Psychiatry. 2021;26(1):247-264.
[13] Zhu H, Guan A, Liu J, et al. Noteworthy perspectives on microglia in neuropsychiatric disorders. J Neuroinflammation. 2023;20(1):223.
[14] Maroun M. Medial prefrontal cortex: multiple roles in fear and extinction. Neuroscientist. 2013;19(4):370-383.





