NRR:中国温州医科大学滕红林/黄智慧/王莹团队揭示药物性靶向cGAS/STING/NF-κB通路调节小胶质细胞极化改善小鼠脊髓损伤修复
撰写:范子伟,贾梦贤
脊髓损伤(Spinal cord injury,SCI)是一种严重的中枢神经系统损伤性疾病,由于其治疗手段有限并且预后不佳,给患者和社会带来严重的负担[1, 2]。SCI后小胶质细胞的M1/M2表型转变在SCI继发性损伤阶段神经炎症的调节中发挥着重要作用[3, 4]。如何调控SCI后脊髓小胶质细胞的M1向M2极化表型转变显得至关重要。研究发现,中枢神经创伤后环状GMP-AMP合酶(Cyclic GMP-AMP synthase, cGAS)-内质网蛋白刺激因子(Stimulator of interferon genes, STING)轴能够触发核因子-κB(Nuclear factor-κB, NF-κB)通路的激活,而NF-κB是小胶质细胞向M1表型极化的关键转录因子[5, 6]。因此,靶向cGAS/STING/NF-κB通路可能是创伤性SCI后调节小胶质细胞源性神经炎症并促进神经保护的潜在临床前治疗策略。有研究表明,色胺酮(Tryptanthrin, Tryp)在体外被证明能够有效抑制小胶质细胞源性炎症,然而其在SCI中的作用和机制尚不明确。利用Tryp探索SCI后小胶质细胞极化的特点和作用有助于更好地理解靶向性小胶质细胞源性神经炎症对SCI后功能恢复的重要性,并为SCI的治疗提供新的治疗策略。
温州医科大学附属第一医院滕红林教授、杭州师范大学药学院黄智慧教授与杭州市第一人民医院王莹研究员团队在《中国神经再生研究(英文)》(Neural Regeneration Research)2025年第11期发表的研究发现,色胺酮(Tryptanthrin, Tryp)可在体外通过抑制cGAS/STING/NF-κB通路激活从而促进BV2细胞向M2型(抑炎型)极化并抑制其炎症反应、减弱其神经毒性。进一步研究证实,色胺酮通过抑制脊髓损伤区域内小胶质细胞中cGAS/STING/NF-κB通路活性,从而抑制SCI后神经炎症、改善小鼠脊髓组织修复和运动功能恢复。该文提示:cGAS/STING/NF-κB通路是调控SCI后小胶质细胞表型的潜在靶点,且色胺酮是治疗SCI的潜在药物。范子伟和贾梦贤为论文共同第一作者,滕红林教授、黄智慧教授以及王莹研究员为论文共同通讯作者。
小胶质细胞是中枢神经系统中固有免疫的主要成分之一,是介导SCI后继发性炎症的主要因素[7]。为了探索Tryp 对小胶质细胞源性炎症反应的作用及其潜在机制,研究者使用了脂多糖(LPS, 1μg/ml)诱导的BV2细胞体外炎症模型用于模拟SCI后脊髓损伤中心附近的小胶质细胞特征[8]。首先,研究者发现经LPS诱导后,BV2细胞显著转为了具有阿米巴样形态的、促炎因子(IL-6、IL-1β和TNF-α)表达增多的M1样表型,而Tryp以剂量依赖性的方式抑制这种极化改变(图1A-E)。进一步通过免疫荧光染色和蛋白免疫印迹检测小胶质细胞M1/M2标记物CD86、CD206,发现Tryp以剂量依赖性的方式抑制LPS对BV2细胞的极化作用,并在最大剂量(10μM)时有效促进其转变为M2表型(图1H-M)。这些结果表明,Tryp可在体外有效地促进小胶质细胞向M2型极化,并抑制小胶质细胞源性促炎细胞因子的表达。

图1 Tryp通过促进小胶质细胞向 M2 表型的极化来抑制小胶质细胞源性炎症
(图源:Fan Z, et al., Neural Regen Res, 2025)
最近的研究表明,LPS可诱导细胞稳态失调而使细胞质内双链DNA(dsDNA)积聚,从而激活环状GMP-AMP合酶(cGAS)-干扰素基因刺激因子(STING)通路,其下游核因子-κB(NF-κB)随即激活入核,最终将活化小胶质细胞转变为M1型[9]。因此,研究者进一步检测在体外探究Tryp是否通过抑制cGAS/STING/NF-κB信号通路活性从而促进小胶质细胞向M2型极化。首先,研究者通过蛋白免疫印迹检测上述通路相关蛋白,发现LPS显著激活BV2细胞中的cGAS/STING/NF-κB信号通路,而Tryp能显著抑制该通路的激活作用(图2A-H)。随后,为进一步验证结论,该研究团队使用STING的特异性激动剂—SR-717[10]而进行了挽救实验。实验发现SR-717可显著激活cGAS/STING以及下游的NF-κB通路(图2I-P),并且可以部分性恢复由Tryp引起的促炎因子(IL-6、IL-1β和TNF-α)表达下降以及BV2细胞向M2型极化的作用(图2Q-X)。这些结果表明,Tryp通过抑制cGAS/STING/NF-κB通路的激活而促进小胶质细胞向M2型极化,最终缓解其源性的炎症反应。
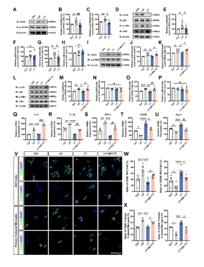
图2 Tryp通过抑制cGAS/STING/NF-κB通路促进小胶质细胞向M2极化
(图源:Fan Z, et al., Neural Regen Res, 2025)
接下来,研究者为了进一步探究Tryp靶向cGAS/STING/NF-κB通路是否可以在体内促进小胶质细胞向M2型极化,构建了以继发性炎症为特征的脊髓损伤夹闭模型。首先,通过蛋白免疫印迹确认了Tryp可使小鼠脊髓内cGAS/STING/NF-κB通路受到抑制(图3A, B, G, H),并通过免疫荧光染色分析发现SCI后第3天脊髓小胶质细胞中cGAS-STING通路可被Tryp显著抑制(图3C-F)。随后,研究者检测了SCI后第7天小胶质细胞表型和炎症因子表达情况,结果表明,Tryp可显著促进SCI后早期小胶质细胞向M2型转变并抑制其促炎因子(IL-6、IL-1β和TNF-α)表达,而促进抑炎因子(CD206和Arg-1)表达(图3I-T)。这些结果表明,在小鼠SCI后,Tryp可通过有效抑制小胶质细胞cGAS/STING/NF-κB通路激活而促进其向M2型极化,最终抑制其介导的炎症反应。
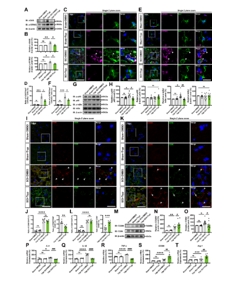
图3 Tryp靶向抑制小鼠小胶质细胞cGAS/STING/NF-κB通路激活从而促进其在脊髓损伤后向M2型极化
(图源:Fan Z, et al., Neural Regen Res, 2025)
为了检测Tryp对SCI是否有治疗作用,研究人员首先对各组小鼠在SCI后各个时间节点进行了行为学分析,包括BMS(Basso Mouse Scale)评分和足迹分析。结果显示,从SCI后第14天开始,SCI + Tryp组小鼠BMS评分较SCI + DMSO组(对照组)小鼠显著更高(图4A);足迹分析的结果也与之类似,自SCI后第14天开始,Tryp处理的小鼠步长恢复效果较对照组显著更好(图4B-C)。接下来,研究人员检测了小鼠脊髓的组织修复情况。SCI后第7天,SCI + Tryp组小鼠脊髓腹侧、背侧的血肿面积均较对照组更小(图4E, F);HE染色结果显示,SCI后第7、14天,SCI + Tryp组小鼠脊髓损伤面积均较对照组更小(图4G, H);油红O染色结果则显示,SCI后第7、14天,SCI + Tryp组小鼠脊髓展现了较对照组更小的炎症浸润范围(图4I, J)。这些结果表明,Tryp能促进小鼠SCI后组织修复和运动功能恢复。
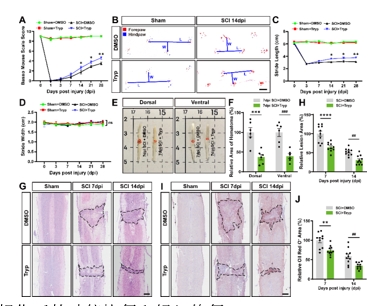
图4 Tryp促进小鼠脊髓损伤后的功能恢复和组织修复
(图源:Fan Z, et al., Neural Regen Res, 2025)
研究表明,SCI后的运动功能恢复与腹侧运动神经元的存活以及脊髓损伤中心及其周围的轴突再生、再髓鞘化密切相关[11-13]。因此,SCI后第14天,研究者首先对神经元的保留情况进行了Nissl染色以及免疫荧光染色分析,发现Tryp显著缓解了SCI后脊髓腹侧神经元的丢失(图5A-D)。并通过蛋白免疫印迹检测SCI后第7天的凋亡蛋白表达情况,结果显示Tryp显著抑制了神经元凋亡(图5E-G)。接下来,研究者使用免疫荧光染色检测了SCI后第28天的轴突再生以及再髓鞘化情况,发现SCI + Tryp组小鼠脊髓损伤中心及其周围区域轴突再生及其再髓鞘化较SCI + DMSO组小鼠显著改善(图5H-L)。上述这些结果说明,Tryp减少了SCI引起的脊髓腹侧神经元丢失。
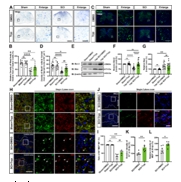
图5 Tryp减少小鼠脊髓损伤后神经元丢失
(图源:Fan Z, et al., Neural Regen Res, 2025)
最后,为了探究Tryp诱导的小胶质细胞源性炎症微环境的改善能否促进SCI后神经元的存活,采用经Tryp预处理的BV2细胞的上清作为孵育N2a细胞的条件性培养基,用以构建条件性共培养系统。首先,通过蛋白免疫印迹以及免疫荧光分析了N2a细胞的凋亡相关蛋白表达情况,结果显示LPS + DMSO预处理的BV2细胞上清(LD-CM)可显著诱导N2a细胞凋亡,而LPS + Tryp预处理的BV2细胞上清(LT-CM)诱导的N2a凋亡情况较前者显著改善。接下来,为了进一步确定Tryp预处理的BV2细胞对N2a细胞展现的神经保护功能的潜在机制,研究者检测了N2a细胞中内质网应激这一与神经元凋亡密切相关的通路激活情况[14]。蛋白免疫印迹以及免疫荧光结果显示,LD-CM可导致N2a细胞中内质网应激显著激活,而LT-CM可显著抑制这种激活,这个结果与上述的凋亡结果相符。上述结果表明,Tryp改善小胶质细胞源性炎症微环境,从而抑制神经元中内质网应激相关凋亡。
图6 Tryp预处理的小胶质细胞可抑制内质网应激相关的神经元凋亡
(图源:Fan Z, et al., Neural Regen Res, 2025)
总之,cGAS/STING/NF-κB轴在体外和SCI小鼠模型中对小胶质细胞极化和神经炎症起到关键作用。该研究表明,Tryp靶向抑制SCI后cGAS/STING/NF-κB通路激活可促进小胶质细胞向M2型分化,从而抑制SCI后小胶质细胞源性神经炎症和脊髓腹侧神经元丢失,最终利于小鼠功能恢复。因此,通过cGAS/STING/NF-κB途径调控小胶质细胞M1/M2极化,可作为SCI等神经炎症性疾病的治疗靶点,此外,该文章从药理学角度为临床SCI的治疗提供可能。
当然该研究有一定的局限性。该研究关注于SCI后小胶质细胞对Tryp治疗的反应。由于研究范围和技术的限制,研究者们未能排除SCI后星形胶质细胞和(或)其他细胞中cGAS/STING/NF-κB轴参与损伤修复的可能性。此外,在中枢神经系统疾病进展中的小胶质细胞激活和神经炎症中已报告了性别上的差异[15, 16]。SCI后,雌性小鼠的预后优于雄性小鼠[16]。而该研究仅选择了雄性小鼠进行研究,Tryp对SCI雌性小鼠脊髓中小胶质细胞cGAS/STING/NF-κB轴的药物灭活作用是否为性别相关性,这在今后值得进一步研究。
参考文献
[1] Jiang B, Sun D, Sun H, et al. Prevalence, incidence, and external causes of traumatic spinal cord injury in China: A nationally representative cross-sectional survey. Front Neurol. 2021;12:784647.
[2] Alizadeh A, Dyck SM, Karimi-Abdolrezaee S. Traumatic spinal cord injury: an overview of pathophysiology, models and acute injury mechanisms. Front Neurol. 2019;10:282.
[3] Kwiecien JM, Dabrowski W, Dabrowska-Bouta B, et al. Prolonged inflammation leads to ongoing damage after spinal cord injury. PLoS One. 2020;15:e0226584.
[4] Zhou X, He X, Ren Y. Function of microglia and macrophages in secondary damage after spinal cord injury. Neural Regen Res. 2014;9:1787-1795.
[5] Ablasser A, Chen ZJ. cGAS in action: Expanding roles in immunity and inflammation. Science. 2019. doi: 10.1126/science.aat8657
[6] Jiang C, Chen Z, Wang X, et al. Curcumin-activated olfactory ensheathing cells improve functional recovery after spinal cord injury by modulating microglia polarization through APOE/TREM2/NF-kappaB signaling pathway. J Neuroimmune Pharmacol. 2023;18:476-494.
[7] Li C, Wu Z, Zhou L, et al. Temporal and spatial cellular and molecular pathological alterations with single-cell resolution in the adult spinal cord after injury. Signal Transduct Target Ther. 2022;7:65.
[8] Liu Z, Yao X, Sun B, et al. Pretreatment with kaempferol attenuates microglia-mediate neuroinflammation by inhibiting MAPKs-NF-kappaB signaling pathway and pyroptosis after secondary spinal cord injury. Free Radic Biol Med. 2021;168:142-154.
[9] Li MZ, Wen XY, Liu XQ, et al. LPS-Induced Activation of the cGAS-STING Pathway is Regulated by Mitochondrial Dysfunction and Mitochondrial DNA Leakage in Endometritis. J Inflamm Res. 2022;15:5707-5720.
[10] Chin EN, Yu C, Vartabedian VF, et al. Antitumor activity of a systemic STING-activating non-nucleotide cGAMP mimetic. Science. 2020;369:993-999.
[11] Huang CX, Zhao Y, Mao J, et al. An injury-induced serotonergic neuron subpopulation contributes to axon regrowth and function restoration after spinal cord injury in zebrafish. Nat Commun. 2021;12:7093.
[12] Chen J, Shifman MI. Inhibition of neogenin promotes neuronal survival and improved behavior recovery after spinal cord injury. Neuroscience. 2019;408:430-47.
[13] Llorens-Bobadilla E, Chell JM, Le Merre P, et al. A latent lineage potential in resident neural stem cells enables spinal cord repair. Science. 2020. doi: 10.1126/science.abb8795
[14] Penas C, Guzman MS, Verdu E, et al. Spinal cord injury induces endoplasmic reticulum stress with different cell-type dependent response. J Neurochem. 2007;102:1242-1255.
[15] Villa A, Gelosa P, Castiglioni L, et al. Sex-specific features of microglia from adult mice. Cell Rep. 2018;23:3501-3511.
[16] Li Y, Ritzel RM, Lei Z, et al. Sexual dimorphism in neurological function after SCI is associated with disrupted neuroinflammation in both injured spinal cord and brain. Brain Behav Immun. 2022;101:1-22.





