NRR:福州大学陈文锋和福建省妇幼保健院王心睿团队成功构建2型腓骨肌萎缩和癫痫果蝇模型
撰文:陈文锋
钠钾泵,又称Na+/K+-ATP 酶,是一种在所有动物细胞膜中均有发现的电跨膜ATP酶,可在生理学中执行多种功能。钠钾泵对于兴奋性细胞,如对刺激做出反应并传递脉冲的神经细胞,尤其重要[1]。钠钾泵功能障碍可导致多种疾病,如肾上腺高血压、癫痫和神经变性[2-4]。腓骨肌萎缩是一组遗传性神经系统疾病,约每2500人中就有1人受到影响;患者可见周围神经损伤[5]。已报道了组成钠钾泵的重要亚基ATP1A1中的某些氨基酸突变可导致2型腓骨肌萎缩(CMT2)和难治性癫痫发作[6-8]。但是尚未建立合适的模拟ATP1A1基因突变的动物模型用于致病机制的研究。
最近中国福州大学陈文锋和福建省妇幼保健院王心睿团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)上发表了题为“Drosophila models used to simulate human ATP1A1 gene mutations that cause Charcot-Marie-Tooth type 2 disease and refractory seizures”的研究,以基因编辑手段修改编码Atpα(人ATP1A1的果蝇同源物)的基因,开发了果蝇CMT2模型。当果蝇Atpα发生与人类CMT2相应突变时,部分果蝇可表现出明显的运动性能缺陷、神经元形态异常和寿命缩短,以及一些模仿经典CMT2和癫痫样发作特征的表型。这些CMT2模型将为研究钠钾泵功能和调节提供新的途径,也将为研究CMT2和相关癫痫病的发病机制和潜在治疗提供平台。
为检查人ATP1A1突变引起的致病性是否可以在果蝇中重现,陈文锋和王心睿等首先评估了人ATP1A1 与其在果蝇中的同源物Atpα的相似性,得出两者在蛋白质序列水平的总体同一性约为80%(图1)。ATP1A1中8种[6, 8]与CTM2相关的残基中的6种在果蝇Atpα中保守(p.I592、p.A597、p.P600,p.D601,p.D811和p.G877)(图1)。接下来使用CRISPR/Cas9基因组编辑技术将I592T(dI571T),A597T(dA576T),P600T(dP579T)和D601F(dD580F)对应的突变同时引入果蝇Atpα基因中(图1)。将这个同时包含4种点突变I571T,A576T,P579T和D580F的模型命名为AtpαTTTF。此外,采用相同的策略来生成单点突变果蝇(AtpαI571T,AtpαA576T,AtpαP579T和AtpαD580F)。另外,还获得了1种缺失突变等位基因(Atpαmut)。在这些等位基因中存在2种可以是纯合的(AtpαI571T和AtpαP579T),另4种(AtpαTTTF/+,AtpαA576T/+,AtpαD580F/+和Atpαmut/+)只能由杂合子维持。但AtpαD580F/+的后代中存在纯合个体,而这些纯合个体是不育的。为进一步了解这些等位基因的遗传特征,实验将Atpαmut/+与其他携带不同等位基因的个体杂交。除AtpαTTTF和AtpαI571T外,所有其他等位基因均可与Atpαmut形成杂合子。这表明ATP1A1对应的CMT2相关突变等位基因可能涉及功能丧失或显性失活,情况可能更加复杂。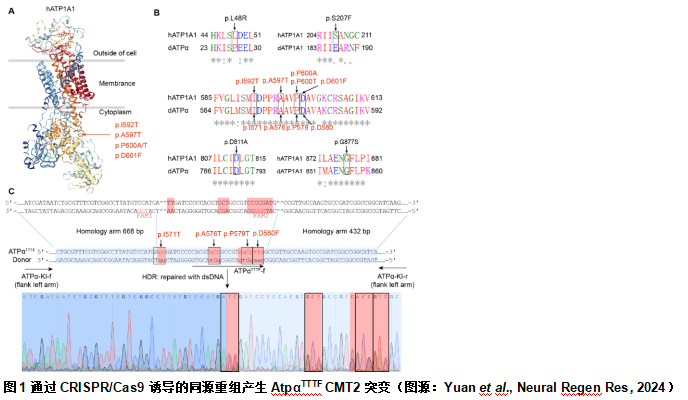
此外,陈文锋和王心睿等预测了蛋白质结构,确定这些CMT2相关突变对整体蛋白质结构的影响有限。细胞质区域仍然保留了3个明确的细胞质结构域:A(致动器)、N(核苷酸结合)和 P(磷酸化)结构域(图2)。4种单点突变可导致残基ATP1A1pI592位置发生了微小结构改变,可将残基从无规则卷曲转变为β-折叠片段(图2)。ATP1A1TTTF突变不仅改变了ATP1A1pI592残基的位置,还改变了ATP1A1pA597残基原来的随机卷曲,使其成为α螺旋的一部分(图2)。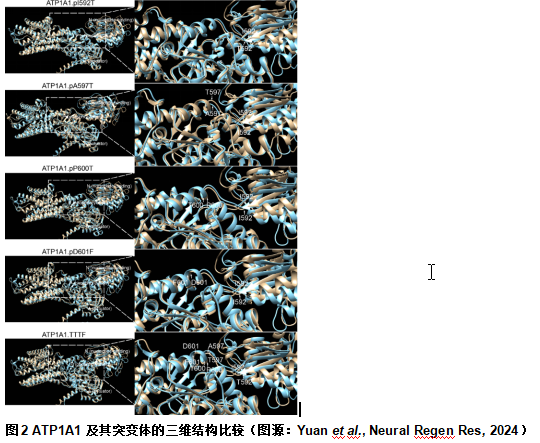
为了研究携带CMT2突变的Atpα的表达是否导致Na+失衡,陈文锋和王心睿等使用钠绿探针监测果蝇大脑中Na+含量。与对照组相比,携带CMT2突变的AtpαTTTF等位基因杂合果蝇的全脑细胞内Na+含量大约高出2倍(图3)。除AtpαA576T/+,AtpαD580F/+和Atpαmut/+外,所有其他等位基因与对照组相比,全脑细胞内Na+含量更高(图3)。此外,作者还发现大多数CMT2果蝇(AtpαTTTF/+,AtpαI571T,AtpαI571T/+,AtpαA576T/+,AtpαD580F/+和Atpαmut/+)的Na+/K+-ATP酶活性显著降低(图3)。当果蝇用哇巴因(一种钠钾泵抑制剂)处理时,CMT2果蝇对毒素没有抵抗力,表明Atpα中具有CMT2突变的果蝇与具有野生型泵的果蝇一样对哇巴因敏感。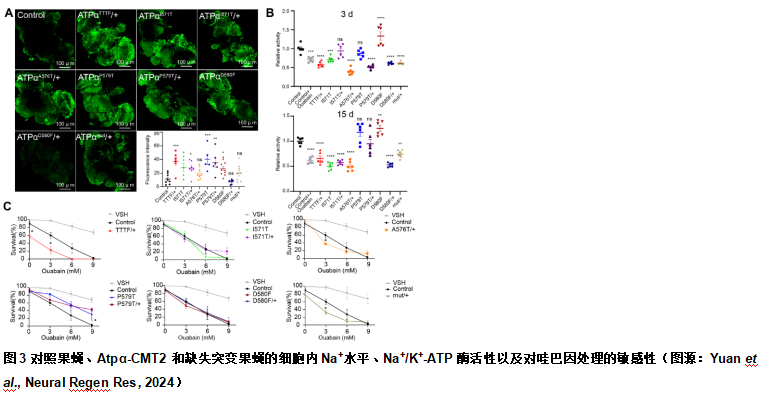
陈文锋和王心睿等还评估了Atpα等位基因突变的果蝇是否存在运动性能缺陷。3和15d龄的Atpα-CMT2 和缺失突变果蝇(AtpαI571T/+,AtpαA576T/+,AtpαP579T/+和AtpαD580F/+除外)在攀爬测定中均具有显著的运动性能缺陷(图4)。只有AtpαTTTF/+,AtpαI571T/+,AtpαP579T/+和Atpαmut/+等位基因的果蝇的寿命缩短(图4)。总的来说,这些结果表明携带CMT2突变的Atpα等位基因的表达在果蝇中具有致病性,并且等位基因之间的影响不同。 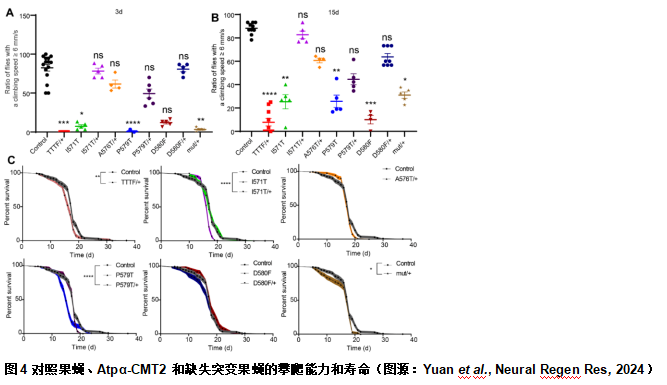
由于CMT2患者的外周运动和感觉神经元受到影响,陈文锋和王心睿等使进一步确定携带CMT2突变的Atpα等位基因是否导致神经元的形态缺陷。首先评估了神经肌肉接头形态是否受到影响,发现Atpα-CMT2 和缺失突变果蝇中的突触数量明显减少,突触长度也明显缩短(图5)。此外,除了AtpαD580F/+和Atpαmut/+外,所有其他杂合Atpα-CMT2果蝇的感觉神经元的树突分支均显著减少(图5)。除Atpαmut/+外,Atpα-CMT2果蝇中节律神经元回路轴突的复杂性显著降低(图5)。因此,携带CMT2突变的Atpα等位基因的果蝇具有终末轴突变性,再现了CMT2疾病的特征。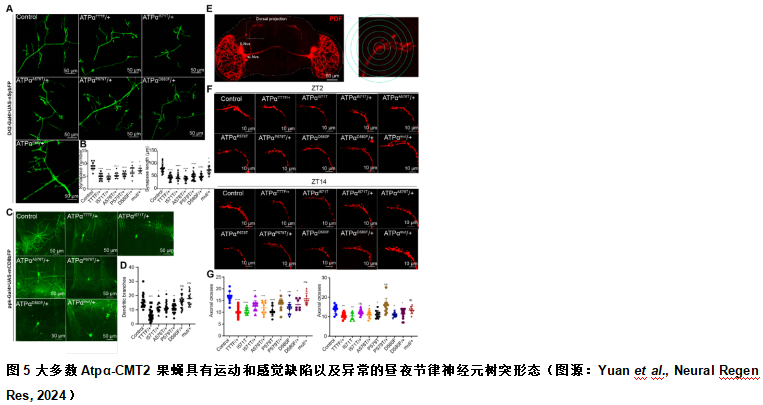
据报道,钠钾泵功能的紊乱会导致神经退行性病变[9],因此陈文锋和王心睿等使评估具有CMT2相关突变的Atpα表达是否会引发严重的神经缺陷。通过脑细胞凋亡评估神经缺陷表明,带有AtpαTTTF,AtpαI571T和AtpαP579T等位基因的果蝇大脑中细胞凋亡增加(图6)。这些结果表明AtpαTTTF/+,AtpαI571T,AtpαI571T/+和AtpαP579T CMT2突变导致大脑神经系统缺陷。此前发表的研究表明,中枢神经系统钠钾泵功能受损会导致癫痫发作[7]。对3和15d龄的AtpαTTTF/+果蝇进行短暂的机械冲击会导致癫痫样表型,而在对照组中未观察到这种现象(图6)。令人惊讶的是,这种行为在30d的AtpαTTTF/+果蝇中减弱(图7)。此外,作者测试了其他CMT2果蝇,只发现AtpαI571T相关果蝇表现出癫痫样表型(图7)。总之,AtpαTTTF/+果蝇在作者测试的所有表型中均呈阳性,而其他等位基因在多个表型中表现出差异。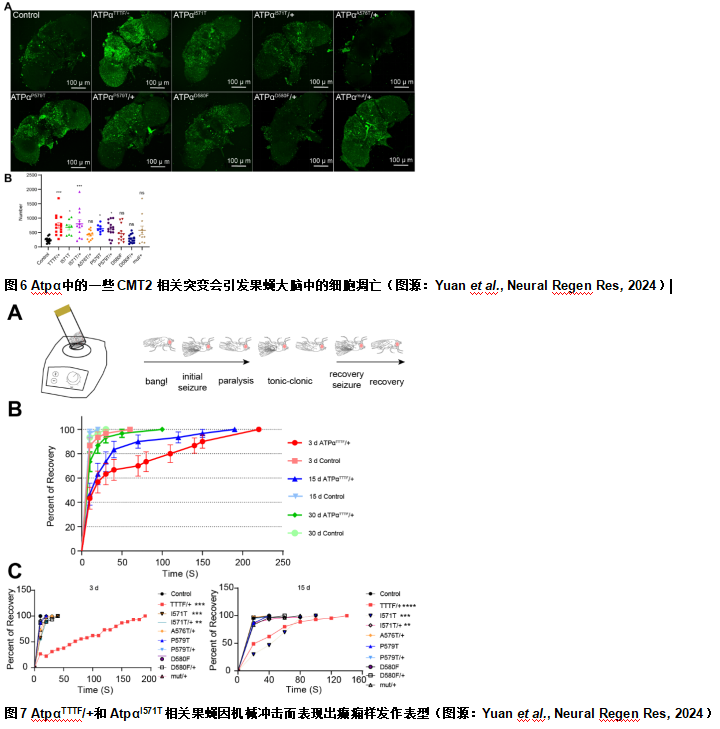
综上所述,该研究的CMT2模型将为研究钠钾泵功能和调节提供新方法。了解CMT2相关突变引起的泵功能障碍的分子基础将为进一步研究CMT2和相关癫痫病的发病机制和潜在治疗提供平台。尽管如此,该研究也有一些问题值得关注:虽然果蝇模型提供了有价值的见解,但它们可能无法完全捕捉CMT2和难治性癫痫等人类疾病的复杂性。该研究重点是特定的表型,如运动表现、寿命、癫痫发作和神经元形态。这些表型可能不涵盖CMT2和癫痫发作的全部临床表现。虽然果蝇模型为ATP1A1相关疾病提供了宝贵的见解,但研究人员在解释这些发现并将其应用于人类时应考虑这些局限性。可能需要结合其他因素和不同模型系统进行进一步研究,以全面了解 CMT2、癫痫发作和相关疾病的机制。
参考文献
[1] Pivovarov AS, Calahorro F, Walker RJ. Na(+)/K(+)-pump and neurotransmitter membrane receptors. Invert Neurosci. 2018;19(1):1.
[2] Grisar T, Guillaume D, Delgado-Escueta AV. Contribution of Na+,K(+)-ATPase to focal epilepsy: a brief review. Epilepsy Res. 1992;12(2):141-149.
[3] Azizan EA, Poulsen H, Tuluc P, et al. Somatic mutations in ATP1A1 and CACNA1D underlie a common subtype of adrenal hypertension. Nat Genet. 2013;45(9):1055-1060.
[4] Kinoshita PF, Leite JA, Orellana AM, et al. The influence of Na(+), K(+)-ATPase on glutamate signaling in neurodegenerative diseases and senescence. Front Physiol. 2016;7:195.
[5] Braathen GJ. Genetic epidemiology of Charcot-Marie-Tooth disease. Acta Neurol Scand Suppl. 2012(193):iv-22.
[6] Lassuthova P, Rebelo AP, Ravenscroft G, et al. Mutations in ATP1A1 cause dominant Charcot-Marie-Tooth Type 2. Am J Hum Genet. 2018;102(3):505-514.
[7] Schlingmann KP, Bandulik S, Mammen C, et al. Germline de novo mutations in ATP1A1 cause renal hypomagnesemia, refractory seizures, and intellectual disability. Am J Hum Genet. 2018;103(5):808-816.
[8] He J, Guo L, Lin S, et al. ATP1A1 mutations cause intermediate Charcot-Marie-Tooth disease. Hum Mutat. 2019;40(12):2334-2343.
[9] Fergestad T, Olson L, Patel KP, et al. Neuropathology in Drosophila mutants with increased seizure susceptibility. Genetics. 2008;178(2):947-956.





