NRR︱解放军总医院康红军团队认为间充质干细胞外泌体疗法有望成为急性中枢神经系统损伤治疗的希望#br#
#br#
撰写:刘育妍,康红军
中枢神经系统相关疾病是全球范围内造成残疾的最大因素。其中,高度持续和反复的急性中枢神经系统损伤(Acute CNS Injury)最终会导致不可逆的神经功能障碍,其中小胶质细胞所引起的炎症反应失调在早期神经炎症中发挥了不容忽视的作用。间充质干细胞(mesenchymal stem cells, MSCs)由于其方便获取、来源广、数量多、免疫原性低且不受伦理限制等诸多优势,逐渐成为近年来神经领域研究的热点。而随着研究的深入,人们发现MSCs进入体内后主要是通过分泌外泌体(exosomes, Exos)来发挥调节作用。间充质干细胞来源的外泌体(mesenchymal stem cell-derived exosomes, MSC-Exos)可透过血脑屏障,并将MSCs的活性成分(如蛋白、核酸等)输送至中枢神经系统损伤区域,发挥治疗作用。同时,Exos可最大程度的规避机体发生的免疫排斥反应,减少引发感染、脑血栓等多种疾病的风险。然而MSC-Exos可能通过什么机制、通路对小胶质细胞表型转换产生影响,从而在神经炎症初期对中枢神经系统起到调节和保护的作用机制仍缺乏深入而全面的总结。
近期,解放军总医院第一医学中心康红军团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)发表了题为“Mesenchymal stem cell-derived exosomes regulate microglia phenotypes: a promising treatment for acute central nervous system injury”的综述文章。作者通过对急性中枢神经系统损伤时小胶质细胞表型转化进行分析,发现神经保护性小胶质细胞在促进神经损伤修复和减轻神经炎症方面的突出作用,总结了与MSC-Exos调节小胶质细胞表型转换相关的多种细胞、动物实验及临床试验,并归纳了其可能的作用机制。另外,该文章中提出MSC-Exos作为中枢神经系统的药物治疗策略,在未来有广阔的应用前景。#br#
在急性中枢神经系统损伤(如:脑卒中(包括缺血性脑卒中、脑出血、蛛网膜下腔出血)、创伤性脑损伤、热射病神经损伤、感染等)发生后,脑组织局部缺血、坏死后的几分钟内,缺氧和能量的匮乏会引发一系列连锁反应,如氧化应激和炎症反应,导致的神经元兴奋性中毒和神经细胞死亡。受损细胞释放的病原相关分子模式(PAMPs)或危险相关分子模式(DAMPs)的信号,导致急性炎症介质和促炎细胞因子急剧增长(如:肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、活性氧(ROS)和细胞间粘附分子-1(ICAM-1)等)。这些炎性介质作用与邻近的神经元,会导致神经元水肿、加剧氧化应激、神经元进行性凋亡,进而导致血脑屏障(BBB)破坏,加剧神经炎症反应[1]。此外,在持续的病理状态下,炎症产物、红细胞代谢物和神经元抗原会导致自身免疫反应激活,刺激缺血区的多种效应细胞激活,如小胶质细胞[2]。作为中枢神经系统的免疫调节细胞,小胶质细胞的激活一方面会吞噬和清除异常或多余的蛋白质以维持大脑中蛋白质负担的平衡,防止神经变性的发生;另一方面,小胶质细胞驱动的炎症反应进一步产生多种促炎症介质,共同调节脑炎综合症,从而加剧缺血缺氧后脑损伤[3]。#br#
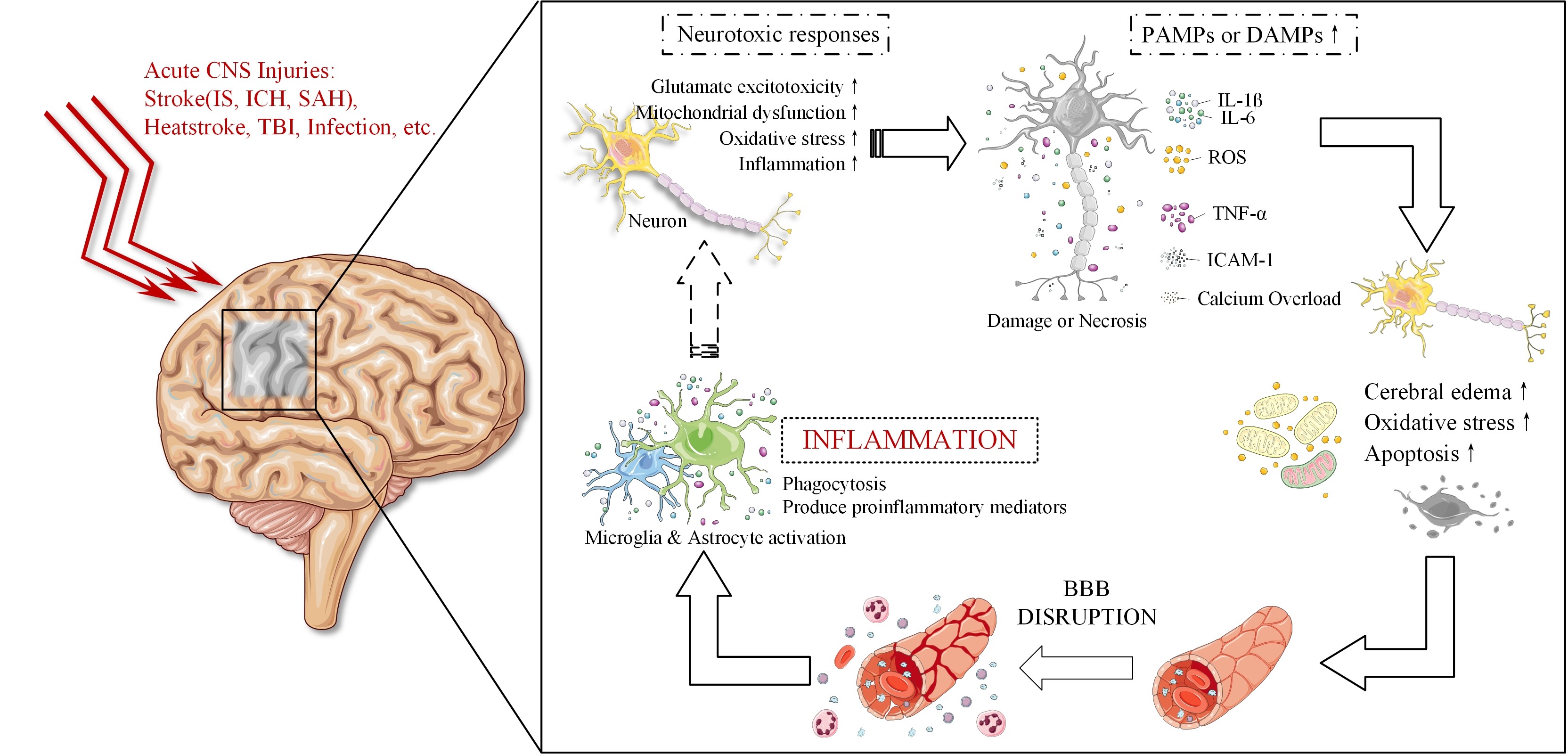 #br#
图1 急性中枢神经系统损伤后神经炎症的恶性循环
#br#
图1 急性中枢神经系统损伤后神经炎症的恶性循环
小胶质细胞是中枢神经系统(central nervous system,CNS)中固有的免疫细胞,在正常发育和病理情况下均对神经系统的免疫防御发挥重要作用。在非病理学条件下,CNS中处于“稳态/平衡小胶质细胞”的突触不断伸长和收缩,并利用微膜结构对周围细胞健康进行免疫监测,维持大脑免疫微环境的稳态[4]。而当中枢神经系统处于缺血、创伤、感染、炎症微环境时,小胶质细胞迅速转化为反应性、不稳定的表型,作为第一道防线,在正常组织和损伤组织之间形成屏障。然而,在过度伤害性刺激下,环境驱动的小胶质细胞过度活化所引起的相关促炎反应过度激活,则通常被视为负面事件。小胶质细胞对创伤和各种免疫刺激反应下,释放炎性介质IL-1β、TNF-α和IL-15,会直接加重各类神经细胞的损伤和神经元损伤,从而放大局部炎性反应,进一步加重血脑屏障的通透性。此外,活化的小胶质细胞通过细胞表面受体、信号转导和转录因子等效应子触发多种信号通路。例如,PKB/AKT、mTOR、p38MAPK等信号通路。在中枢神经系统损伤的发展过程中,小胶质细胞表现出不同的神经毒性和神经保护特性,这与疾病过程中表现出的不同活化表型有关。然而,小胶质细胞的激活状态对特定条件的反应有所不同,不同表型的小胶质细胞群会表现出不同的分子特征和生理功能。国外研究团队曾报道过[5]多种中枢神经系统疾病(包括神经变性疾病、衰老、炎性刺激和缺血性损伤)的小鼠模型中比较小胶质细胞/髓样细胞表达谱。另一个实验室使用单细胞RNAseq分析5个月大的成年小鼠的小胶质细胞,鉴定出一组稳态小胶质细胞高度富集的转录物簇“Sensome”[6]。此外,神经保护启动状态的变化与参与神经保护的小胶质细胞中基因表达的总体增加有关。提示不同小胶质细胞的分子亚型与其神经保护和CNS毒性特征有关。其中,信号转导通路参与小胶质细胞活化对急性CNS炎症的调节。IRF/STAT/SOCS信号、NF-κB激活、核受体(PPARγ,PPARδ,RXR)和氧化还原信号(Nrf2,NOX2,HIF-1)的抑制因子控制小胶质细胞的表型转化。最近的一项研究指出,稳态小胶质细胞向反应性小胶质细胞的转换激活依赖于模式识别受体(PRRs)的选择性激活。除了常见的信号转导因子外,c-AMP应答元件结合蛋白(CREB)、STAT-1/6、过氧化物酶体增殖物激活受体(PPAR)-γ和Krüppel样因子(KLF)在小胶质细胞表型调节中均起关键作用。
间充质干细胞(mesenchymal stem cells, MSCs)是一种起源于早期发育中胚层的、具有免疫系统调节功能的多功能干细胞(multifunctional progenitor cells),广泛分布于器官的结缔组织中[7]。近年来,间充质干细胞来源的外泌体(mesenchymal stem cell-derived exosomes, MSC-Exos)在神经系统中发挥的作用受到了日益广泛关注。MSC-Exos内的治疗分子受到天然的脂质双分子层保护,这确保了稳定性、生物相容性、低免疫原性以及克服机体生物屏障(如血脑屏障)到达CNS的能力。在CNS病变中,MSC-Exos帮助维持细胞稳态,清理神经系统中的蛋白聚集体等致病因素,在神经保护、突触活动调节及小胶质细胞表型转化等方面发挥重要作用。#br#
在MSC-Exos中包含着多种关键RNA(包括mRNAs, miRNAs, lncRNAs, circRNAs, snRNAs)及膜和细胞质蛋白成分,并通过多种方式传递给效应细胞,如:1)Exos膜蛋白可与靶细胞膜蛋白受体结合;2) Exos膜蛋白可在细胞外基质中被剪切,其碎片可作为配体与受体结合;3)Exos膜可直接与靶细胞膜融合,在细胞中释放出内容物发挥其作用等。另外,不同来源的MSC-Exos可能包含特定的小分子物质,会在调控小胶质细胞表型转换时发挥不同的作用。#br#
 #br#
图2 间充质干细胞来源的外泌体中所包含的多种小分子物质或是调控小胶质细胞表型转换的关键靶点
#br#
图2 间充质干细胞来源的外泌体中所包含的多种小分子物质或是调控小胶质细胞表型转换的关键靶点
MSCs会根据培养环境的变化而改变其细胞特性和功能,并通过Exos来应对免疫微环境的变化,维持免疫微环境的稳定[8]。在中枢神经系统损伤后,免疫/炎症细胞的激活释放炎症介质,如TNF-α和IL-1β,迅速影响微环境的变化。MSCs一旦被激活,其旁分泌的Exos发挥免疫抑制作用并控制炎症过程[9]。同时,小胶质细胞释放的促炎症因子增强了MSCs的调节能力,这反过来又改变了小胶质细胞的激活状态[10]。这表明在内源性MSCs和小胶质细胞对其免疫功能的调节之间可能存在一个反馈回路。MSC-Exos主要通过三种途径调节小胶质细胞的激活:前列腺素E2(PGE2)、TSG-6[11]和糖皮质激素受体(GR)孕酮受体(PR)[12]。MSCs可被促炎症信号激活并释放PGE2,促使小胶质细胞从促炎症表型向抗炎症表型转变。活化的MSCs分泌TSG-6,它与小胶质细胞上的CD44相互作用,减少TLR2/NF-κB信号,从而减少促炎症介质的分泌。大量的证据表明,TLR在脑缺血损伤中起着至关重要的作用。例如,TLR-2在大脑中高度表达,TLR-2的缺乏有助于减少小鼠大脑的缺氧缺血损伤[13]。此外,TLR 4激动剂可通过上调小胶质细胞的吞噬活性,加强清除与几种不同中枢神经系统疾病相关的受损组织和异常蛋白质聚集物[14]。PGE2和TSG-6之间的负反馈回路使MSCs作为炎症早期阶段的调节器。第三条途径则由小胶质细胞表面受体GR和PR连接,它们决定了小胶质细胞的表型转化。GR属于类固醇受体超家族,作为配体依赖的转录因子发挥作用。一些证据支持,小胶质细胞的过度激活可以通过激活小胶质细胞GR来明显抑制,它可以保护黑质中的多巴胺神经元(DNs),并通过调节小胶质细胞中NF-κB和AP-1的转录活动来调节炎症[15]。#br#
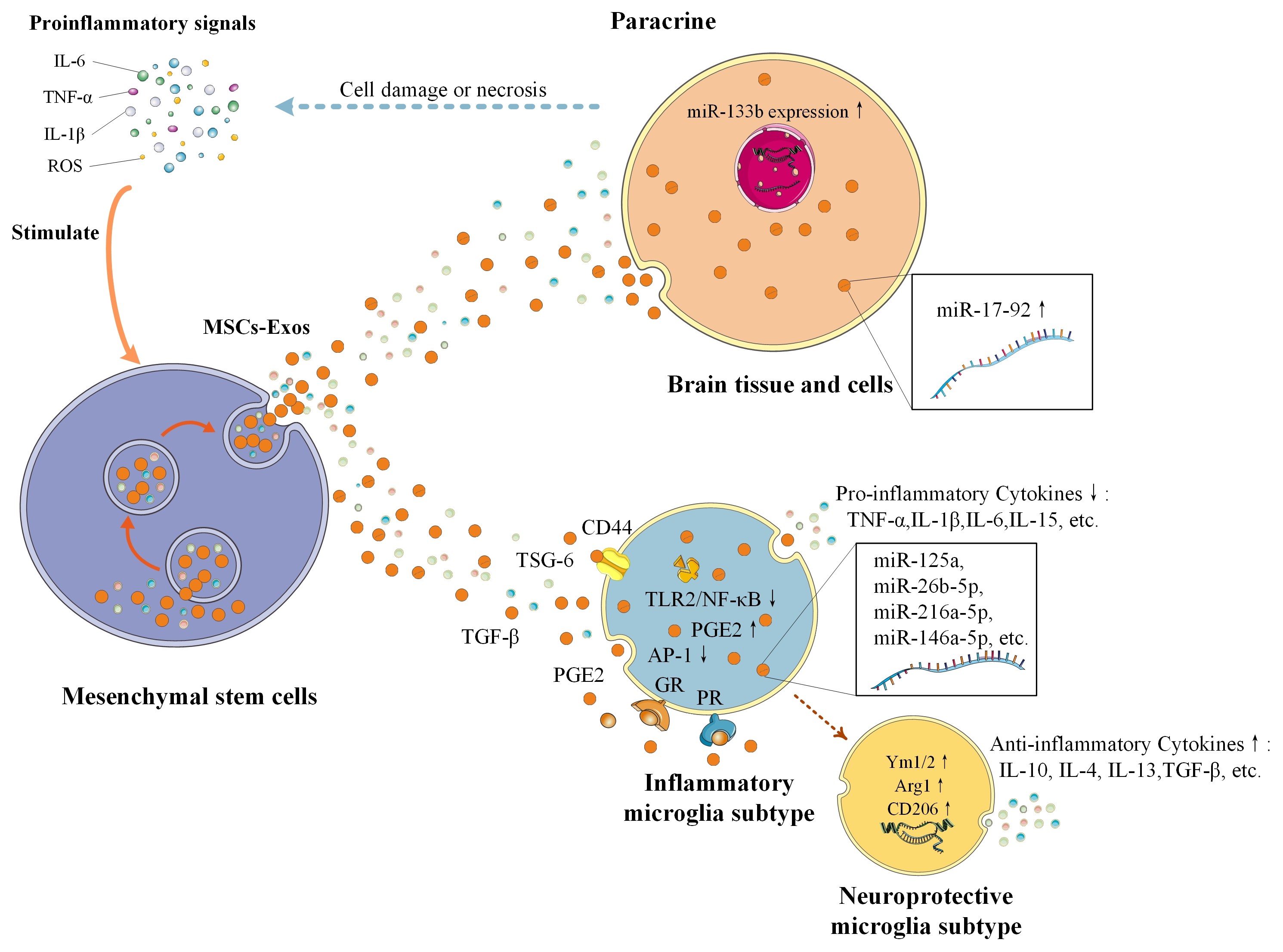 #br#
图3 间充质干细胞通过多种途径调节炎症反应
#br#
图3 间充质干细胞通过多种途径调节炎症反应
但MSCs的治疗效果往往是有限的,在某些情况下,原始的MSCs的抗炎功能不足以挽救神经炎症的损害。由于BBB的限制性,脑内皮细胞必须经过复杂的转细胞作用才能将大分子物质输送到大脑;否则,配体和/或受体会被引导到错误的质膜上,当特异性可以通过表面配体的修饰来增加和控制时,就会被降解。在蛋白质和仿肽介导的给药途径中,药物被设计成针对细胞上的特定受体,如用生物相容性聚合物进行表面涂层,表面净电荷修饰,以及添加大脑特异性配体和细胞穿透肽,以获得通过障碍物或集中于目标器官的能力[16]。过去十年的多项研究表明,间充质干细胞移植治疗以及旁分泌效应可以改善各种啮齿动物模型中的各种急性中枢神经系统损伤。从动物研究到临床试验,越来越多的数据表明,间充质干细胞可以通过多种途径介导小胶质细胞表型转化,以改善中枢神经系统损伤的急性神经炎症反应,发挥神经保护和修复作用。
另外诱导多能干细胞(Induced pluripotent stem cell,iPSCs)衍生的MSCs(iMSCs)是再生医学中自体细胞治疗的另一个细胞来源,且iPSCs是体细胞被重新编程为多能细胞[17]。与MSCs相比,它的一个显著优势是可以产生无限数量、质量稳定的早期患者个体化iMSCs。与iPSCs类似,胚胎干细胞(embryonic stem cells,ESCs)具有再生特性,特别是具有很强的分泌Exos的能力[18]。虽然多项研究已经证明了多能干细胞在治疗中枢神经系统疾病方面的临床潜力,但ESC/iPSC-MSCs-Exos治疗改善中枢神经系统损伤动物预后的潜在机制仍不确定。此外,在广泛应用之前,仍然需要克服多能细胞的低效重编程并诱导其稳定分化。因此,相较于ESC/iPSC-MSCs-Exos,应用MSCs-Exos治疗仍有诸多优势。
总之, MSC-Exos中多种活性物质会对神经系统损伤时小胶质细胞的促炎性反应产生影响,从而发挥其神经保护作用。虽然现代多技术突破了小胶质细胞表型的发展,但对中枢神经损伤后神经炎症中小胶质细胞反应的多样性仍缺乏全面了解。此外,MSCs-Exos是否能尽快应用于临床,需要考察其标准化剂量及给药方式下的疗效和敏感性,以及药代动力学和生物分布。此外,科学家们有必要研究如何提高产量和纯度,以便能够比较出MSCs-Exos最大的治疗效果。还可以通过在体外模仿中枢神经系统的炎症环境,如使用炎症因子预处理MSCs,或对小胶质细胞促炎症反应信号的特定机制及其表型进行基因改造等手段,增加MSCs-Exos的治疗效果。届时,Exos将由转染、修饰过的MSCs分泌,或将特定的miRNA装载至MSCs-Exos,整合到Exos中并在体内传递,以专门针对特定的炎症,也将是未来重要的发展方向。
解放军医学院研究生刘育妍、李云和王陆为该综述的共同作者,康红军教授为通讯作者。#br#
#br#
原文链接:xxxx#br#
#br#
参考文献:#br#
1. Barichello T, Generoso JS, Goularte JA, et al. Does infection-induced immune activation contribute to dementia? Aging Dis. 2015;6:342-348.#br#
2. Wolf SA, Boddeke H, Kettenmann H. Microglia in physiology and disease. Annu Rev Physiol. 2017;79:619-643.#br#
3. Loane DJ, Byrnes KR. Role of microglia in neurotrauma. Neurotherapeutics. 2010;7:366-377.#br#
4. Colonna M, Butovsky O (2017) Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 2017;35:441-468#br#
5. Friedman BA, Srinivasan K, Ayalon G, Meilandt WJ, Lin H, Huntley MA, Cao Y, Lee S-H, Haddick PC, Ngu H. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer’s disease not evident in mouse models. Cell Rep. 2018;22:832-847#br#
6. Hickman SE, Kingery ND, Ohsumi TK, Borowsky ML, Wang LC, Means TK, El Khoury J. The microglial sensome revealed by direct RNA sequencing. Nat Neurosci. 2013;16:1896-1905.#br#
7. Majumdar MK, Thiede MA, Mosca JD, Moorman M, Gerson SL. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J Cell Physiol. 1998;176:57-66#br#
8. Liu J, Kuwabara A, Kamio Y, Hu S, Park J, Hashimoto T, Lee JW. Human mesenchymal stem cell‐derived microvesicles prevent the rupture of intracranial aneurysm in part by suppression of mast cell activation via a PGE2‐dependent mechanism. Stem Cells. 2016;34:2943-2955#br#
9. Ma S, Xie N, Li W, Yuan B, Shi Y, Wang Y. Immunobiology of mesenchymal stem cells. Cell Death Differ. 2014;21:216-225#br#
10. Rahmat Z, Jose S, Ramasamy R, Vidyadaran S. Reciprocal interactions of mouse bone marrow-derived mesenchymal stem cells and BV2 microglia after lipopolysaccharide stimulation. Stem Cell Res Ther. 2013;4:12.#br#
11. Prockop DJ. Concise review: two negative feedback loops place mesenchymal stem/stromal cells at the center of early regulators of inflammation. Stem Cells. 2013;31:2042-2046.#br#
12. Schumacher M, Mattern C, Ghoumari A, Oudinet J, Liere P, Labombarda F, Sitruk-Ware R, De Nicola AF, Guennoun R. Revisiting the roles of progesterone and allopregnanolone in the nervous system: resurgence of the progesterone receptors. Prog Neurobiol. 2014;113:6-39#br#
13. Stridh L, Smith PL, Naylor AS, Wang X, Mallard C. Regulation of toll-like receptor 1 and-2 in neonatal mice brains after hypoxia-ischemia. J Neuroinflammation. 2011;8:1-10#br#
14. Leitner GR, Wenzel TJ, Marshall N, Gates EJ, Klegeris A. Targeting toll-like receptor 4 to modulate neuroinflammation in central nervous system disorders. Expert Opin Ther Targets. 2019;23:865-882#br#
15. Maatouk L, Compagnion A-C, Sauvage M-AC-d, Bemelmans A-P, Leclere-Turbant S, Cirotteau V, Tohmé M, Beke A, Trichet M, Bazin V. TLR9 activation via microglial glucocorticoid receptors contributes to degeneration of midbrain dopamine neurons. Nat Commun. 2018;9:1-15#br#
16. Azarmi M, Maleki H, Nikkam N, Malekinejad H. Transcellular brain drug delivery: a review on recent advancements. Int J Pharm. 2020;586:119582.#br#
17. Lee WH, Chen WY, Shao NY, Xiao D, Qin X, Baker N, Bae HR, Wei TT, Wang Y, Shukla P. Comparison of non-coding RNAs in exosomes and functional efficacy of human embryonic stem cell-versus induced pluripotent stem cell-derived cardiomyocytes. Stem Cells. 2017;35:2138-2149#br#
18. Bi Y, Qiao X, Liu Q, Song S, Zhu K, Qiu X, Zhang X, Jia C, Wang H, Yang Z, Zhang Y, Ji G. Systemic proteomics and miRNA profile analysis of exosomes derived from human pluripotent stem cells. Stem Cell Res Ther. 2022;13:449.#br#
#br#
 #br#
通讯作者介绍:康红军,医学博士,主任医师,教授,博士生导师,美国哈佛大学医学院访问学者。现任解放军总医院第一医学中心重症医学科副主任。#br#
从事危重病医学、复杂感染性疾病、热射病相关研究、临床大数据与人工智能、干细胞与免疫等领域研究。以第一/通讯作者发表论文40余篇,SCI 收录20篇。主持国家自然科学基金、科技部重大专项、省部级课题15项。获军队医疗成果二等奖1项,北京市医学科技二等奖1项。#br#
#br#
通讯作者介绍:康红军,医学博士,主任医师,教授,博士生导师,美国哈佛大学医学院访问学者。现任解放军总医院第一医学中心重症医学科副主任。#br#
从事危重病医学、复杂感染性疾病、热射病相关研究、临床大数据与人工智能、干细胞与免疫等领域研究。以第一/通讯作者发表论文40余篇,SCI 收录20篇。主持国家自然科学基金、科技部重大专项、省部级课题15项。获军队医疗成果二等奖1项,北京市医学科技二等奖1项。#br#
 #br#
第一作者介绍:刘育妍,医学学士,现就读于中国人民解放军医学院。#br#
主要研究方向:间充质干细胞及其外泌体在危重病医学中的应用
#br#
第一作者介绍:刘育妍,医学学士,现就读于中国人民解放军医学院。#br#
主要研究方向:间充质干细胞及其外泌体在危重病医学中的应用
 #br#
图1 急性中枢神经系统损伤后神经炎症的恶性循环
#br#
图1 急性中枢神经系统损伤后神经炎症的恶性循环
 #br#
图2 间充质干细胞来源的外泌体中所包含的多种小分子物质或是调控小胶质细胞表型转换的关键靶点
#br#
图2 间充质干细胞来源的外泌体中所包含的多种小分子物质或是调控小胶质细胞表型转换的关键靶点
 #br#
图3 间充质干细胞通过多种途径调节炎症反应
#br#
图3 间充质干细胞通过多种途径调节炎症反应
 #br#
通讯作者介绍:康红军,医学博士,主任医师,教授,博士生导师,美国哈佛大学医学院访问学者。现任解放军总医院第一医学中心重症医学科副主任。#br#
从事危重病医学、复杂感染性疾病、热射病相关研究、临床大数据与人工智能、干细胞与免疫等领域研究。以第一/通讯作者发表论文40余篇,SCI 收录20篇。主持国家自然科学基金、科技部重大专项、省部级课题15项。获军队医疗成果二等奖1项,北京市医学科技二等奖1项。#br#
#br#
通讯作者介绍:康红军,医学博士,主任医师,教授,博士生导师,美国哈佛大学医学院访问学者。现任解放军总医院第一医学中心重症医学科副主任。#br#
从事危重病医学、复杂感染性疾病、热射病相关研究、临床大数据与人工智能、干细胞与免疫等领域研究。以第一/通讯作者发表论文40余篇,SCI 收录20篇。主持国家自然科学基金、科技部重大专项、省部级课题15项。获军队医疗成果二等奖1项,北京市医学科技二等奖1项。#br#
 #br#
第一作者介绍:刘育妍,医学学士,现就读于中国人民解放军医学院。#br#
主要研究方向:间充质干细胞及其外泌体在危重病医学中的应用
#br#
第一作者介绍:刘育妍,医学学士,现就读于中国人民解放军医学院。#br#
主要研究方向:间充质干细胞及其外泌体在危重病医学中的应用