NRR:南通大学陈婷婷团队报道在不同神经细胞中,钾和钙通道可作为神经系统疾病的治疗靶点
撰文:陈婷婷,邱晴
中枢神经系统是体内信息整合的中枢,主要由神经元和神经胶质细胞组成。神经元和神经胶质细胞作为多种不同的神经细胞群,在中枢神经系统发育、功能和疾病中发挥着重要作用。神经细胞的表达、结构和功能可能导致神经和神经退行性疾病的发生和发展。离子通道参与神经细胞的功能[1]。钾离子(K+)是分布最广泛的一类离子,其功能主要通过细胞膜上的钾通道实现。钾通道的突变和功能障碍与神经系统和神经退行性疾病密切相关,包括癫痫[2]、帕金森病 [3, 4]、精神分裂症[5]等。电压门控钙通道 (CaV) 是跨膜蛋白,通过膜电位去极化激活。钙通道的突变及其功能失调与多种疾病有关,包括许多脑部疾病。因此,针对这些相关的离子通道,对神经系统疾病的各种药物进行深入的探索,有望为这些疾病的治疗提供更多治疗方向。
南通大学陈婷婷团队在《中国神经再生研究(英文)》(Neural Regeneration Research)2025年第5期发表了综述文章,详细介绍了不同神经细胞中的钾和钙离子通道的分子机制,以及钾和钙离子通道在这些神经元细胞中涉及的神经系统疾病,如帕金森病、阿尔茨海默病、抑郁症、癫痫、自闭症和罕见疾病等。相应地,针对这些相关的离子通道,对治疗神经系统疾病的各种药物进行了深入探索,该文带来的启示:离子通道是治疗神经系统疾病的有效靶点,但通过钾离子或钙离子(新型特异性离子通道调节剂)真正改善这些疾病的临床药物并不多,开发针对神经系统的新型特异性离子通道调节剂,或可有效提高该类疾病治愈率。
钾通道是常见的离子通道家族,广泛表达于中枢和周围神经系统的所有细胞类型中[6]。钾通道由 90 多个基因编码主要成孔亚基 [7]。当K+通道被激活时,这些亚基形成跨细胞膜的钾选择性通道,使K+离子穿过质膜进入细胞质发挥作用。生物体内的钾通道主要包括以下四种类型:电压门控K+通道(KV,外向整流通道)、Ca 2+ 激活K+通道(KCa)、内向整流K+通道(Kir)和串联孔道域 K+ 通道 (K2P)。它们在不同的神经细胞中具有不同的分布特征,其结构和功能也存在显着差异。神经元中的钾通道在设置静息膜电位 [2]、介导动作电位 (AP) 的快速复极化和控制膜电位的阈下振荡方面发挥着重要作用。小胶质细胞的钾通道主要由维持静息膜电位和缓冲细胞外K+[8],K+通道被认为是小胶质细胞相关病理学药物干预的靶点。星形胶质细胞表达多种KV通道亚型,例如KV1、KV3和KV4。星形胶质细胞内质网储存区的Ca 2+ 是动员脑功能的关键。在小胶质细胞中,KATP 通道(Kir6.1 和 Kir6.2)可以促进促炎 M1 表型向抗炎 M2 表型的转变。在大脑中,Kir6.2 主要在神经元中表达,而 Kir6.1 主要在小胶质细胞中表达,这对于 M2 小胶质细胞极化至关重要 [9]。KCa3.1 通道在非兴奋性细胞中充当 Ca 2+ 检测器和 Ca 2+ 放大器。在星形胶质细胞激活过程中,KCa3.1通道可以上调促炎因子,包括白细胞介素(IL)-1β和肿瘤坏死因子α,从而导致神经炎症[10]。在大脑中,星形胶质细胞中检测到了 TASK-1、TWIK-1 和 TREK-1,而小胶质细胞中检测到了 THIK-1 [11]。TREK-1对缺血或缺氧期间形成的许多病理和生理因素敏感[12]。缺血期间,缺血代谢物乳酸通过 PKA 途径升高星形胶质细胞中的 TREK-1 [13]。不同神经细胞中的钾通道在调节神经系统疾病中发挥着不同的作用。KCa通道在神经系统疾病中的报道有限,主要是关于KCa1.1(BK通道)。 KCa1.1(由KCNMA1编码)突变可引起神经系统疾病,如癫痫、小脑萎缩和发育迟缓[14]。
电压依赖性钙通道(Voltage-dependentCacalChannel,CaV)是一种由膜电位去极化激活的跨膜蛋白,将钙信号转导至细胞内,进而触发分泌、收缩、神经传递、基因表达等生理反应。细胞外Ca 2+ 在维持生理功能中发挥着重要作用。已观察到细胞外 Ca 2+ 浓度的变化可调节各种生理和病理生理环境中的神经元兴奋性 [15, 16]。 Ca 2+浓度的减少增加了神经元的兴奋性。根据药理学和序列相似性,CaV分为三个亚科(CaV1、CaV2和CaV3)。其中,CaV3家族CaV3.1-3.3产生T型电流[17]。CaV2家族位于突触前末梢,控制钙依赖性递质的释放和短期突触前可塑性,在神经元细胞体和树突的钙信号传递中发挥重要作用。 CaV2 系列包括 CaV2.1、CaV2.2 和 CaV2.3,CaV2.1 产生 P/Q 电流,Cav1家族的CaV1.1-1.4产生L型电流,突触处的CaV1通道在突触后树突中形成信号复合物,树突棘,调节钙通道活性和长期突触后可塑性[18]。神经元中不同的钙通道介导不同的电流(L、N或P/Q型),位于大脑的不同区域,CaV2.1和CaV2.2通道存在于神经元的突触前末梢,触发神经递质的快速传递,如γ-氨基丁酸(GABA)、乙酰胆碱(ACh)和谷氨酸。研究发现CaV2.1电压依赖性钙通道介导小脑浦肯野细胞中的抑制性神经传递(GABA)[19]。突触前末梢,CaV2.3 通道位于活性区域内或周围,控制运输和释放,从而控制树突中的钙依赖性峰值。突触后神经元胞体中的CaV1.2、CaV1.3通道传导L形电流,影响钙离子的进入,诱导LTP[18]。研究表明,培养的小胶质细胞与激动剂相互作用引发的[Ca 2+ ] 增加对L 通道拮抗剂敏感[20]。提示可能存在L型钙通道。在中枢神经系统炎症过程中,L型电压门控钙通道在控制小胶质细胞的分泌活动中发挥着特定的作用。最近的研究还表明,N 型电压门控钙通道阻断可以诱导寡聚体周围区域的胶质细胞活化,而 CaV2.2 控制小胶质细胞趋化因子的释放 [20]。总体而言,小胶质细胞在正常条件下可能以低水平表达非功能性 CaV,而当受到激活或病理条件下时,CaV 水平会增加并具有更大的功能作用。在此基础上文章总结了神经元、小胶质细胞和星形胶质细胞中的钙通道影响的疾病和治疗,包括癫痫、阿尔茨海默病、帕金森病、自闭症谱系障碍和罕见的神经系统疾病(图 1)。
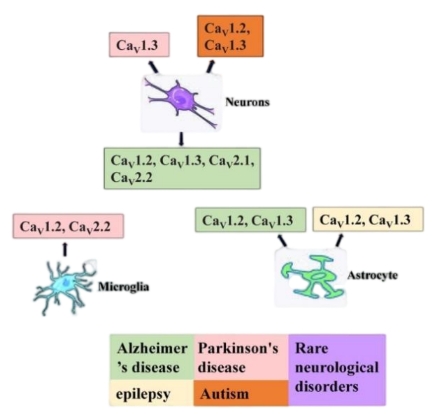 #br#
#br#
图1 不同神经细胞中钙通道与神经功能障碍
#br#
神经细胞中表达的离子通道种类及其亚型较多,参与维持神经细胞的多种生理功能,在神经系统的功能中发挥着重要作用。因此,开发针对此类过程的靶向药物,有望成为延缓或阻止神经系统疾病病理进展的有效治疗策略。此外,给药可能会导致大脑中离子通道的广泛激活或抑制,从而导致神经产生许多意外的副作用。因此,开发能够选择性靶向离子通道特定亚基的小分子/药物对研究进展至关重要。然而,尽管有大量证据证明这些通道在神经元和神经胶质细胞中可能发挥的作用,但所涉及的信号传导途径尚不清楚。未来的研究需要集中于离子通道对神经元或胶质细胞生理功能影响的确切途径。此外,这些神经胶质离子通道调节神经元健康的细胞和分子机制尚不清楚,因此研究这些关键通道的作用是必要的。在未来的研究中,研究神经细胞的通道依赖通路可能为治疗神经疾病创造一类新的药物靶点。
原文链接:https://journals.lww.com/nrronline/fulltext/2025/05000/potassium_and_calcium_channels_in_different_nerve.4.aspx
参考文献
[1] Izquierdo P, Attwell D, Madry C. Ion channels and receptors as determinants of microglial function. Trends Neurosci. 2019;42:278-292.
[2] Nikitin ES, Vinogradova LV. Potassium channels as prominent targets and tools for the treatment of epilepsy. Expert Opin Ther Targets. 2021;25:223-235
[3] Zhang L, Zheng Y, Xie J, et al. Potassium channels and their emerging role in parkinson's disease. Brain Res Bull. 2020;160:1-7
[4] Zhao S, Wang M, Ma Z. Therapeutic potential of ATP-sensitive potassium channels in Parkinson's disease. Brain Res Bull. 2021;169:1-7.
[5] Musselman M, Huynh E, Kelshikar R, et al. Potassium channel modulators and schizophrenia: an overview of investigational drugs. Expert Opin Investig Drugs. 2023;32:471-477
[6] Liu J, Qu C, Han C, et al. Potassium channels and their role in glioma: A mini review. Mol Membr Biol. 2019;35:76-85.
[7] Mondejar-Parreno G, Cogolludo A, Perez-Vizcaino F. Potassium (K(+)) channels in the pulmonary vasculature: Implications in pulmonary hypertension Physiological, pathophysiological and pharmacological regulation. Pharmacol Ther. 2021;225:107835.
[8] Cocozza G, Garofalo S, Capitani R, et al. Microglial potassium channels: from homeostasis to neurodegeneration. Biomolecules. 2021;11:1774
[9] Du RH, Sun HB, Hu ZL,et al. Kir6.1/K-ATP channel modulates microglia phenotypes: implication in Parkinson's disease. Cell Death Dis. 2018;9:404.
[10] Bouhy D, Ghasemlou N, Lively S, et al. Inhibition of the Ca(2)(+)-dependent K(+) channel, KCNN4/KCa3.1, improves tissue protection and locomotor recovery after spinal cord injury. J Neurosci. 2011;31:16298-16308
[11] Talley EM, Solorzano G, Lei Q, et al. Cns distribution of members of the two-pore-domain (KCNK) potassium channel family. J Neurosci. 2001;21:7491-7505.
[12] Burtscher J, Mallet RT, Burtscher M, et al. Hypoxia and brain aging: Neurodegeneration or neuroprotection? Ageing Res Rev. 2021;68:101343.
[13] Banerjee A, Ghatak S, Sikdar SK. l-Lactate mediates neuroprotection against ischaemia by increasing TREK1 channel expression in rat hippocampal astrocytes in vitro. J Neurochem. 2016;138:265-281.
[14] Bailey CS, Moldenhauer HJ, Park SM, et al. KCNMA1-linked channelopathy. J Gen Physiol. 2019;151:1173-1189..
[15] Wang T, Wang J, Cottrell JE, et al. Small physiologic changes in calcium and magnesium alter excitability and burst firing of CA1 pyramidal cells in rat hippocampal slices. J Neurosurg Anesthesiol. 2004;16:201-209.
[16] Xiong ZG, MacDonald JF. Sensing of extracellular calcium by neurones. Can J Physiol Pharmacol. 1999;77:715-721.
[17] El Ghaleb Y, Schneeberger PE, Fernandez-Quintero ML, et al. CACNA1I gain-of-function mutations differentially affect channel gating and cause neurodevelopmental disorders. Brain. 2021;144:2092-2106.
[18] Nanou E, Catterall WA. Calcium channels, synaptic plasticity, and neuropsychiatric disease. Neuron. 2018;98:466-481.
[19] Kettenmann H, Hanisch UK, Noda M, et al. Physiology of microglia. Physiol Rev. 2011;91:461-553.
Nicoletti NF, Erig TC, Zanin RF, et al. Pre-clinical evaluation of voltage-gated calcium channel blockers derived from the spider P. nigriventer in glioma progression. Toxicon. 2017;129:58-67.
#br#
 #br#
#br#