NRR:西北大学附属第一医院张红兵眼科团队聚焦巨噬细胞迁移抑制因子在视网膜疾病中的机制研究进展
撰文:张红兵,张仙娇,李宏松,王昞,陈佩,孟佳敏
巨噬细胞迁移抑制因子(Macrophage migration inhibitory factor, MIF)是一种在激活的T淋巴细胞和巨噬细胞/单核细胞中被发现的一种多效促炎细胞因子,主要参与机体的先天性和适应性免疫反应[1]。MIF也是一种垂体前叶激素,可以在应激或感染性刺激后进入循环反调节糖皮质激素抑制细胞因子的产生。目前研究证实,MIF不仅可以由T淋巴细胞和巨噬细胞/单核细胞产生,也可以由上皮细胞、内皮细胞、垂体前叶细胞、滑膜成纤维细胞和平滑肌细胞等非免疫细胞分泌[2-6]。MIF是多种病理生理过程的重要调控因子,参与细胞分化、增殖和凋亡,在炎症、纤维化、肿瘤发生、血管生成和肿瘤转移的病理过程中起到关键作用,且已有研究表明MIF在肾脏囊肿、感染性和非感染性炎症、自身免疫性疾病甚至恶性肿瘤的发生发展过程中发挥非常重要的作用[5-10]。#br#
近年来,越来越多的研究证实,MIF在眼部疾病,特别是眼底疾病中异常表达,提示MIF可能参与并在眼底疾病中发挥了重要作用。基于此,本文就MIF的结构和功能进行了详细阐述,特别是MIF在眼底疾病中的研究进展进行总结和展望。
西北大学附属第一医院张红兵眼科团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)2024年第2期上发表综述文章,介绍了MIF的基本结构、主要功能和MIF的精细调控,重点介绍了MIF在视网膜炎症性疾病、视网膜新生血管性疾病、视网膜退行性疾病及视神经损伤等视网膜疾病中的作用及研究进展。张红兵主任医师为论文的第一作者及通讯作者。
MIF蛋白超家族主要包括MIF和MIF2。MIF是一种进化上非常保守的细胞因子,常以同源三聚体形式存在。每个单体由两个反向平行的α-螺旋包裹在一个四条链的β-折叠组成。单体之间的界面是由两个额外的β链和相邻亚基的β折叠之间的相互作用形成 [11-13]。MIF发挥功能主要通过两种方式(图1):一是通过非受体介导的内吞作用,MIF与细胞内c-Jun激活结构域结合蛋白(C-Jun activation domain-binding protein 1, JAB1)结合引起下游通路改变[14, 15];二是MIF与CD74/CD44等复合物结合,激活Src家族蛋白激酶,然后激活细胞外信号调节激酶-1/2(phosphatidylinositol 3-kinase/protein kinase B, ERK1/2)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇-3-激酶(phosphoinositide- 3-kinase, PI3K)-Akt级联信号通路、核因子-κB(nuclear factor-κB, NF-κB)信号通路等,也可抑制p53,最终引起下游因子改变[16-20]。MIF通过这些信号通路参与了炎症、细胞增殖、凋亡和存活,以及前列腺素的产生和肿瘤发生的调控。
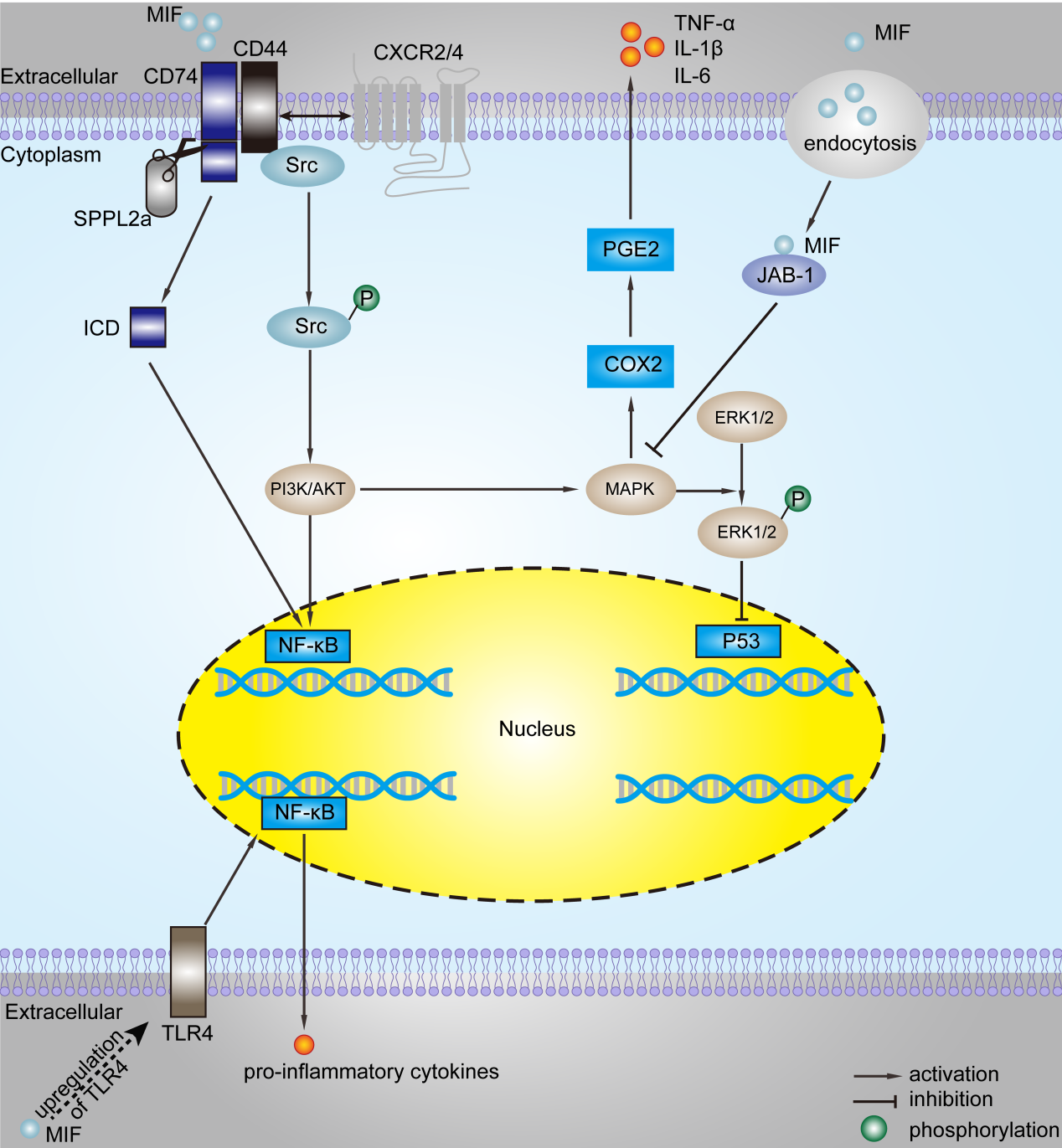
图1 MIF的分子机制
MIF2是由与MIF相邻的基因编码,与MIF具有相似的氨基酸序列、结构和生物活性、互变异构酶活性。人MIF和MIF2的氨基酸序列同源性为33%。MIF2也是一个同源三聚体结构,其整体拓扑结构和三聚体结构与MIF相似。MIF2以剂量依赖的方式减少MIF与CD74胞外结构域的结合[21, 22]。MIF2主要是通过与受体CD74/CD44等结合,激活下游的真核起始因子2α (eukaryotic initiation factor, eIF2α)、分泌性白细胞蛋白酶抑制物(secrete leukocyte proteinase inhibitor, SLPI)、Jab1、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)等通路,引起下游的一系列变化,最终参与调控细胞的增殖和凋亡,细胞的内质网应激反应,以及组织的炎症和新生血管形成等生理病理过程(见图2)[18, 23, 24]。
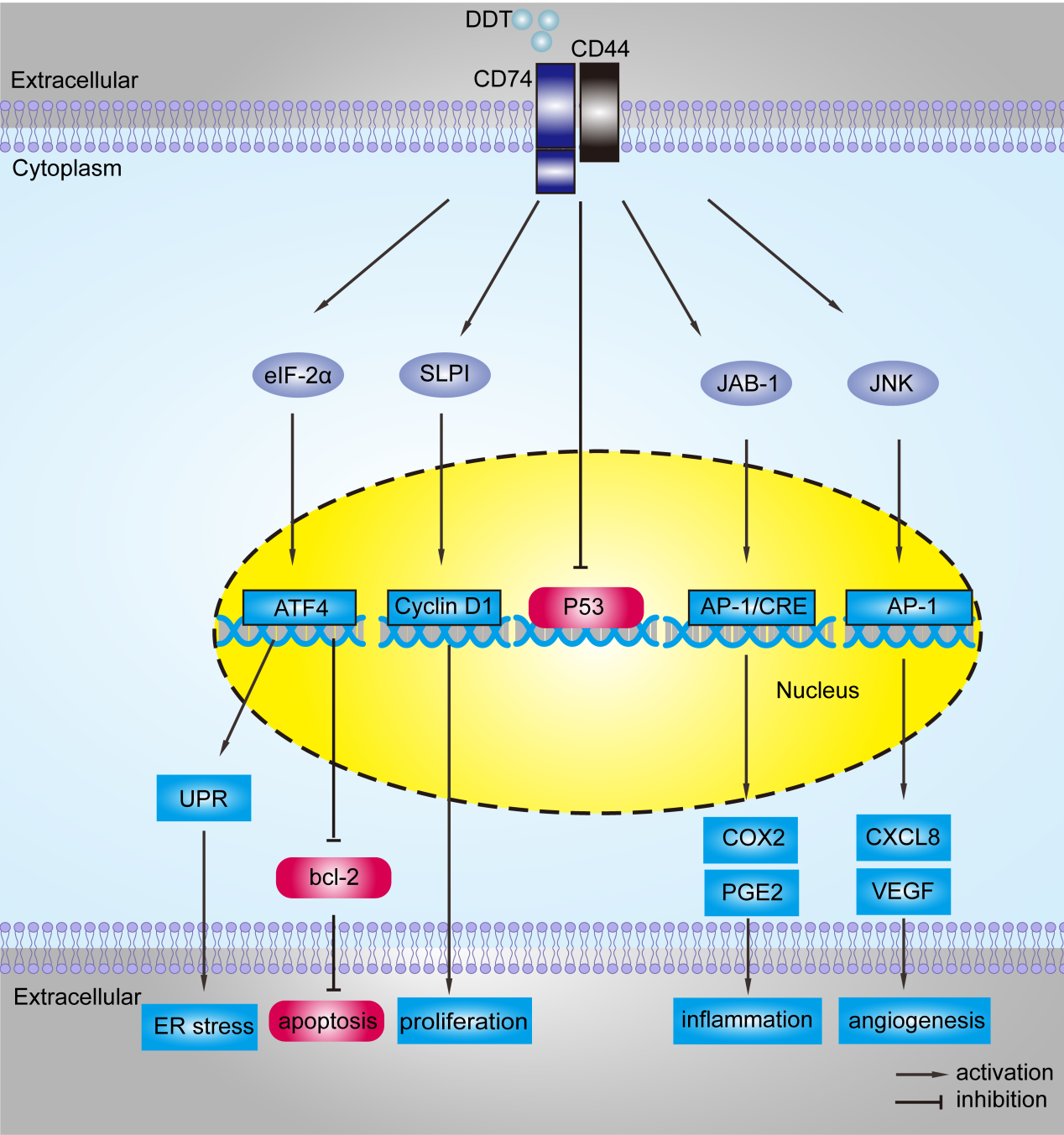
图2 MIF2的分子机制
MIF作为一种重要的免疫调节因子,在眼组织中的分布和作用备受关注。MIF参与调控视网膜的炎症性、新生血管性和退行性疾病,以及视神经疾病和葡萄膜黑色素瘤等疾病的发生发展(图3)。

图3 MIF与视网膜疾病的关系
(1)MIF和视网膜炎症性疾病
在一个由光受体视黄酸结合蛋白诱导的实验性自身免疫性葡萄膜视网膜炎模型中,MIF及其受体的表达增加与炎症的严重程度密切相关[25]。MIF增加促炎细胞因子的释放并加剧了视网膜功能损伤。MIF抑制剂ISO-1减少了疾病模型中Th1和Th17的分化。此外,过表达MIF通过激活Notch信号通路加重眼部炎症,表明MIF 可能通过调节 Notch 信号通路加剧眼内炎症。这些结果提示,调控葡萄膜炎中MIF表达水平的平衡有可能是治疗葡萄膜炎的新策略。
(2)MIF和视网膜新生血管性和/或增殖性疾病
在增殖期糖尿病视网膜病变患者的玻璃体中,MIF、血管内皮生长因子(vascular endothelial growth factor, VEGF)、可溶性细胞间粘附分子-1 (soluble intercellular adhesion molecule-1, sICAM-1)和可溶性CD74的表达显著升高[26]。患者的玻璃体液中MIF水平与VEGF和sICAM-1水平呈正相关。在缺氧培养的Müller细胞中诱导MIF生成,引起ERK1/2磷酸化和VEGF的产生。正常大鼠玻璃体内注射MIF后,视网膜血管通透性增加,视网膜中磷酸化的ERK1/2、NF-κB、血管细胞粘附分子-1和ICAM-1的表达显著增加。MIF还能促进视网膜微血管内皮细胞的增殖和迁移。这些研究结果表明,MIF可能与增殖期糖尿病视网膜病变的进展密切相关。
(3)MIF和视网膜退行性疾病
视网膜炎症被认为是年龄相关性黄斑变性的发病机制之一。在年龄相关性黄斑变性的小鼠模型中,670 nm LED通过降低神经视网膜中MIF和TNF-α蛋白表达来减弱先天免疫反应,进而降低视网膜的炎症,表明MIF可能参与调控年龄相关性黄斑变性的发病过程[27]。在实验性视网膜脱离的小鼠模型中,MIF抑制剂ISO-1抑制了视网膜胶质细胞增生、光感受器凋亡和外核层变薄。ISO-1上调Müller细胞中pERK表达,表明抑制MIF信号可能阻断视网膜脱离病理损伤反应,有利于视功能恢复[28]。
(4)视神经病变
在一项成年大鼠神经节细胞变性的研究中发现,MIF显著降低视神经附近的小胶质细胞活性,从而减少小胶质细胞诱导的视网膜自我破坏性反应,保护受伤的视神经免受继发性损伤,并促进自体移植的视网膜神经节细胞再生[29, 30]。然而,另有研究并没有发现MIF对视神经切除术后大鼠视网膜小胶质细胞激活的显著影响[31]。因此,MIF在视神经损伤中的作用尚需进一步的研究。
(5)葡萄膜黑色素瘤
成人葡萄膜黑色素瘤是常见的眼内恶性肿瘤,是一种高危致命性疾病[32-34]。研究证实,来自原发性和转移性葡萄膜黑色素瘤的细胞系分泌MIF,而且MIF剂量依赖性地抑制NK细胞介导的小鼠淋巴瘤细胞系YAC-1和葡萄膜黑色素瘤细胞溶解,提示人葡萄膜黑色素瘤细胞分泌的活性MIF可以抑制NK细胞介导的杀伤作用[35]。当免疫检查点阻断治疗发生耐药性时,抗细胞毒性T淋巴细胞相关抗原4与MIF抑制剂联合应用可能是一种新的治疗方法[36]。
玻璃体视网膜疾病是一类复杂的眼底疾病,尽管我们在许多眼底疾病的发病机制和临床治疗方面取得了很大进展,但是仍有许多问题困扰着眼科科研人员和临床医生,比如老年黄斑变性,尽管应用抗VEGF药物治疗脉络膜新生血管取得了显著进展,但是使视网膜下瘢痕形成和瘢痕形成依旧严重损伤视功能,因此,积极研究这些疾病的发病机制和探索新的治疗策略仍然很有必要。MIF是一种重要的细胞因子,在免疫反应、炎症反应、神经内分泌和酶促反应中发挥重要作用,初步研究发现其表达水平在许多视网膜疾病中发生了显著变化,包括老年黄斑变性,但是这些变化的作用和机制尚不清楚,应用MIF类药物防治这些与MIF变化有关的视网膜疾病更是没有研究。因此,积极研究MIF在这些视网膜疾病中的作用和机制,并积极研究改变MIF表达水平对这些疾病转归的影响程度,将有可能开启认识和治疗一些复杂视网膜疾病的新领域。
原文链接:https://doi.org/10.4103/1673-5374.379020
参考文献
1. Bloom BR, Bennett B. Mechanism of a reaction in vitro associated with delayed-type hypersensitivity. Science. 1966;153:80-82.
2. Klemke L, De Oliveira T, Witt D, et al. Hsp90-stabilized MIF supports tumor progression via macrophage recruitment and angiogenesis in colorectal cancer. Cell Death Dis. 2021;12:155.
3. Qiao C, Li S, Lu H, et al. Laminar flow attenuates macrophage migration inhibitory factor expression in endothelial cells. Sci Rep. 2018;8:2360.
4. Nishino T, Bernhagen J, Shiiki H, et al. Localization of macrophage migration inhibitory factor (MIF) to secretory granules within the corticotrophic and thyrotrophic cells of the pituitary gland. Mol Med. 1995;1:781-788.
5. Bernhagen J, Calandra T, Mitchell RA, et al. MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia. Nature. 1993;365:756-759.
6. Leech M, Metz C, Hall P, et al. Macrophage migration inhibitory factor in rheumatoid arthritis: evidence of proinflammatory function and regulation by glucocorticoids. Arthritis Rheum. 1999;42:1601-1608
7. Gadjeva M, Nagashima J, Zaidi T, et al. Inhibition of macrophage migration inhibitory factor ameliorates ocular Pseudomonas aeruginosa-induced keratitis. PLoS Pathog. 2010;6:e1000826.
8. Reidy T, Rittenberg A, Dwyer M, et al. Homotrimeric macrophage migration inhibitory factor (MIF) drives inflammatory responses in the corneal epithelium by promoting caveolin-rich platform assembly in response to infection. J Biol Chem. 2013;288:8269-8278
9. Luo Y, Wang X, Shen J, et al. Macrophage migration inhibitory factor in the pathogenesis of leukemia (Review). Int J Oncol. 2021;59:62
10. Safi W, Kraus A, Grampp S, et al. Macrophage migration inhibitory factor is regulated by HIF-1alpha and cAMP and promotes renal cyst cell proliferation in a macrophage-independent manner. J Mol Med (Berl). 2020;98:1547-1559.
11. Paralkar V, Wistow G. Cloning the human gene for macrophage migration inhibitory factor (MIF). Genomics. 1994;19:48-51.
12. Sun HW, Bernhagen J, Bucala R, et al. Crystal structure at 2.6-A resolution of human macrophage migration inhibitory factor. Proc Natl Acad Sci U S A. 1996;93:5191-5196.
13. Zan C, Yang B, Brandhofer M, et al. D-dopachrome tautomerase in cardiovascular and inflammatory diseases-A new kid on the block or just another MIF? FASEB J. 2022;36:e22601.
14. Kleemann R, Hausser A, Geiger G, et al. Intracellular action of the cytokine MIF to modulate AP-1 activity and the cell cycle through Jab1. Nature. 2000;408:211-216.
15. Alampour-Rajabi S, El Bounkari O, Rot A, et al. MIF interacts with CXCR7 to promote receptor internalization, ERK1/2 and ZAP-70 signaling, and lymphocyte chemotaxis. FASEB J. 2015;29:4497-4511.
16. Roger T, David J, Glauser MP, et al. MIF regulates innate immune responses through modulation of Toll-like receptor 4. Nature. 2001;414:920-924.
17. Shi X, Leng L, Wang T, et al. CD44 is the signaling component of the macrophage migration inhibitory factor-CD74 receptor complex. Immunity. 2006;25:595-606.
18. Brock SE, Rendon BE, Xin D, et al. MIF family members cooperatively inhibit p53 expression and activity. PLoS One. 2014;9:e99795.
19. Zhang W, Zheng J, Meng J, et al. Macrophage migration inhibitory factor mediates viability and apoptosis of PVM/Ms through PI3K/Akt pathway. Neuroscience. 2017;360:220-229.
20. Chen CA, Chang JM, Yang YL, et al. Macrophage migration inhibitory factor regulates integrin-beta1 and cyclin D1 expression via ERK pathway in podocytes. Biomed Pharmacother. 2020;124:109892.
21. Merk M, Mitchell RA, Endres S, et al. D-dopachrome tautomerase (D-DT or MIF-2): doubling the MIF cytokine family. Cytokine. 2012;59:10-17.
22. Meza-Romero R, Benedek G, Jordan K, et al. Modeling of both shared and distinct interactions between MIF and its homologue D-DT with their common receptor CD74. Cytokine. 2016;88:62-70.
23. Ochi A, Chen D, Schulte W, et al. MIF-2/D-DT enhances proximal tubular cell regeneration through SLPI- and ATF4-dependent mechanisms. Am J Physiol Renal Physiol. 2017;313:F767-780.
24. Coleman AM, Rendon BE, Zhao M, et al. Cooperative regulation of non-small cell lung carcinoma angiogenic potential by macrophage migration inhibitory factor and its homolog, D-dopachrome tautomerase. J Immunol. 2008;181:2330-2337.
25. Yang H, Zheng S, Mao Y, et al. Modulating of ocular inflammation with macrophage migration inhibitory factor is associated with notch signalling in experimental autoimmune uveitis. Clin Exp Immunol. 2016;183:280-293.
26. Abu El-Asrar AM, Ahmad A, Siddiquei MM, et al. The proinflammatory and proangiogenic macrophage migration inhibitory factor is a potential regulator in proliferative diabetic retinopathy. Front Immunol. 2019;10:2752.
27. Kokkinopoulos I. 670 nm LED ameliorates inflammation in the CFH(-/-) mouse neural retina. J Photochem Photobiol B. 2013;122:24-31.
28. Kim B, Kusibati R, Heisler-Taylor T, et al. MIF inhibitor ISO-1 protects photoreceptors and reduces gliosis in experimental retinal detachment. Sci Rep. 2017;7:14336.
29. Thanos S, Mey J, Wild M. Treatment of the adult retina with microglia-suppressing factors retards axotomy-induced neuronal degradation and enhances axonal regeneration in vivo and in vitro. J Neurosci. 1993;13:455-466.
30. Thanos S, Mey J. Type-specific stabilization and target-dependent survival of regenerating ganglion cells in the retina of adult rats. J Neurosci. 1995;15:1057-1079.
31. Sobrado-Calvo P, Vidal-Sanz M, Villegas-Perez MP. Rat retinal microglial cells under normal conditions, after optic nerve section, and after optic nerve section and intravitreal injection of trophic factors or macrophage inhibitory factor. J Comp Neurol.2007;501:866-878.
32. Bilmin K, Synoradzki KJ, Czarnecka AM, et al. New perspectives for eye-sparing treatment strategies in primary uveal melanoma. Cancers (Basel). 2021;14:134.
33. Toro MD, Gozzo L, Tracia L, et al. New therapeutic perspectives in the treatment of uveal melanoma: a systematic review. Biomedicines. 2021;9:1311.
34. Reichstein DA, Brock AL. Radiation therapy for uveal melanoma: a review of treatment methods available in 2021. Curr Opin Ophthalmol. 2021;32:183-190.
35. Repp AC, Mayhew ES, Apte S, et al. Human uveal melanoma cells produce macrophage migration-inhibitory factor to prevent lysis by NK cells. J Immunol. 2000;165:710-715.
36. de Azevedo RA, Shoshan E, Whang S, et al. MIF inhibition as a strategy for overcoming resistance to immune checkpoint blockade therapy in melanoma. Oncoimmunology. 2020; 9:1846915.
作者介绍
 #br#
#br#
张红兵,男,医学博士,眼科主任医师,博士研究生导师,博士后合作导师,美国堪萨斯大学医学中心访问学者,西安市眼科学科带头人。现任西北大学附属第一医院(西安市第一医院)副院长,兼任国家眼科疾病临床研究中心陕西分中心主任、陕西省眼科疾病临床研究中心主任、陕西省眼科学重点实验室主任、陕西省眼科研究所副所长。从事眼科临床和科研工作29年,擅长玻璃体视网膜疾病和复杂性白内障的临床诊治,现在主要研究方向为视网膜新生血管性疾病和高度近视发病机制。社会任职:西安市医学会眼视光学分会主任委员、西安市医学会眼科学分会副主任委员、陕西省医学会眼科学分会委员、陕西省医师协会眼科医师分会常务委员、陕西省中西医结合学会眼科学分会常委、陕西省优生优育协会儿童眼病专委会副主任委员、中国眼微循环专业委员会眼影像学组委员、中国研究性学会神经与再生修复委员会委员、中国医师协会眼科医师分会眼底病学组委员、中国康复医学会视觉康复专委会委员、中国老年医学学会眼科分会委员、陕西省妇女健康促进会第四届副会长。主持国家自然科学基金1项,陕西省科技厅课题2项,西安市市级课题1项,共发表中英文学术论文36篇,其中SCI论文12篇,参与本专业共识指南的制定3项。获西安市科技进步三等奖1项,专著和译著各1部,国家专利2项。



 #br#
#br#