NRR:中国同济大学孙毅团队揭示哺乳动物成体前脑室管膜细胞存在异质性
撰文:杨雪娇,穆宇辰,吴乾祥,周立强,Orion Fan,林泉,朱文敏,孙毅
哺乳动物中枢神经系统的特定区域存在持续的神经发生,并伴随整个生命过程 [1]。在啮齿动物中,成体神经发生的区域包括产生齿状回颗粒神经元的海马齿状回颗粒下区以及侧脑室内壁的室管膜/室管膜下区,该区域不断产生新的神经元,这些神经元沿着喙迁移流迁移到嗅球 [2-4]。成体期啮齿动物的室管膜细胞是否存在神经干细胞一直存在争议。近20年来,研究者们使用了不同的标志物定义室管膜细胞,并得出了迥异的结论。有研究者以Notch1,GFAP和CD133分别定义室管膜细胞,继而通过荧光激活细胞分选、谱系示踪等手段证明室管膜细胞具有干细胞特性。而另一些研究者将Acta2和CD24分别作为室管膜细胞的标志物,断言室管膜细胞不存在成体干细胞。因此,揭示室管膜细胞基因表达的异质性,是回答室管膜是否存在成体干细胞的前提,也有助于对室管膜成体神经干细胞的特征进行更准确的定义。
中国同济大学孙毅团队在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Heterogeneity
of the adult mammalian forebrain neurogenic ependyma: A comprehensive cellular
map”的研究,文章通过单细胞RNA测序及免疫荧光分析揭示了室管膜的不同细胞亚型。其中CD133+多纤毛细胞占室管膜细胞的67.63%,其余32.37%为CD133-。其中CD133+室管膜细胞可分为FOXJ1+/SOX2+/ACTA2+细胞、FLT1+/CD31+/CLDN5+内皮样细胞、PDGFRB+/VTN+/NG2+周细胞样细胞、内皮-周细胞样细胞和Foxj1+内皮样细胞。研究提示,成年小鼠前脑室管膜细胞存在异质性,其中某些亚型可能存在干细胞活性。
为揭示室管细胞在转录组水平的异质性,孙毅等通过单细胞RNA测序评估了成年小鼠室管膜细胞组成。实验将8周龄C57BL/6J雄性小鼠(n = 7)的侧脑室侧壁解剖,并分离成单个细胞,然后以柔性荧光激活细胞分选富集了高CD133表达的室管膜细胞。将CD133+细胞标记为PE细胞,CD133-细胞标记为NC细胞。使用10× Genomics平台对两种细胞进行单细胞RNA测序。根据其特定的基因特征对进行了注释,将室管膜细胞分为11个细胞群,包括神经母细胞、增殖神经母细胞、Gfap+星形胶质细胞、Aqp4+星形胶质细胞、少突胶质细胞、小胶质细胞样细胞、Foxj1+室管膜细胞、内皮样细胞、周细胞样细胞和红细胞(图1)。
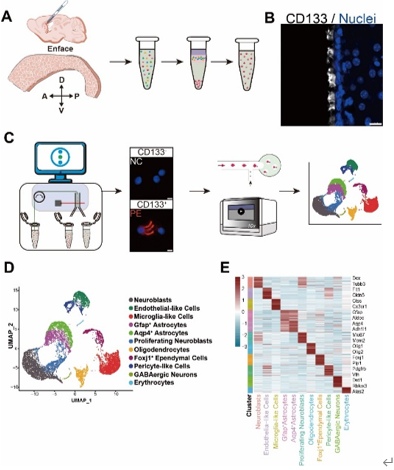
图1 单细胞测序揭示成体小鼠侧脑室侧壁的细胞组成
为了在转录组中筛选与脑脊液接触的单层细胞,即室管膜细胞,孙毅等比较了在PE细胞和NC细胞中富集的细胞群。结果发现,内皮样细胞、周细胞样细胞和Foxj1+室管膜细胞在PE细胞中富集,表明CD133抗体呈阳性。这3群细胞的数量占测序细胞总数的18.75%。之前的研究表明,这些细胞群确实表达高水平的CD133蛋白。实验将这3群高表达CD133的细胞群命名为EPE细胞群(图2)。在PE细胞,即CD133+室管膜细胞中,含有大约50%的内皮样细胞、34%的Foxj1+室管膜细胞和17%的周细胞样细胞(图3),并且这3种细胞亚型之间存在一些重叠。当细胞同时表达内皮细胞和周细胞标记物时,它们被归类为周细胞样细胞,而当细胞同时表达Foxj1和内皮细胞标记物时,它们被视为 Foxj1+室管膜细胞。有趣的是,很少有细胞会同时表达Foxj1和Pdgfrb,这表明这2种室管膜亚型是分开的。
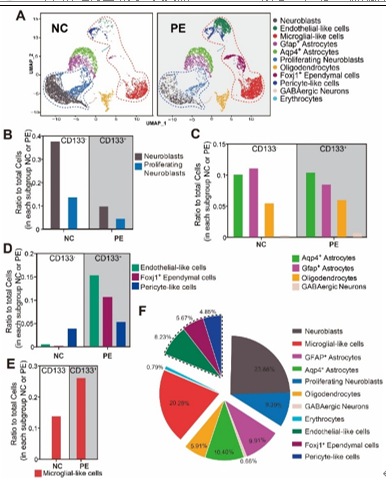
图2 CD133蛋白在内皮样细胞、周细胞样细胞和Foxj1+室管膜细胞,即EPE细胞中富集
关于哺乳动物室管膜中是否含有任何成年神经干细胞的争论很激烈,不同的研究使用不同的标记物来标记成体神经干细胞、室管膜和室管膜下区细胞,得出了不同的结论。因此孙毅等研究了所有以前发表的成体神经干细胞、室管膜和室管膜下区细胞的标志物的表达水平,包括 Prom1、Flt1、Pecam1、Sox17、Cldn5、Nes、Notch1、Pdgfrb、Cspg4、Vtn、Sox2、Foxj1、S100b、Acta2、Cd24a、Vim、Vps35、Ccn1、Gfap、Vcam1、Egfr,以及 EPE 细胞中的两个管家基因Malat1和Actb(图3)。所有这些标志物在转录组中被归为6个类别。第一类(“内皮样细胞”)包括Prom1(CD133)、Flt1、Pecam1(CD31)、Sox17、Cldn5、Nes和Notch1,它们在“内皮样细胞”中高表达,也在“周细胞样细胞”中表达,但在Foxj1+室管膜细胞中不表达;第二类(“周细胞样细胞”)包括Pdgfrb、Cspg4(NG2)和Vtn,它们是“周细胞样细胞”特异性基因;第三类(“Foxj1+室管膜细胞”)包括Sox2、Foxj1、S100b、Acta2和Cd24a,它们在“Foxj1+室管膜细胞”中特异表达;第四类由Vps35和Vim组成,在3种EPE细胞亚群中均有表达,尽管“周细胞样细胞”的表达量与其他两种亚群相比较低;第五类包括Ccn1、Gfap、Vcam1和Egfr,已知它们在室管膜下成体神经干细胞中表达(Hu 等人,2017;Wu 等人,2020a);第六类为管家基因(图3)。这些结果清楚地表明,所有先前表明室管膜不含有成体神经干细胞的研究都只研究了Foxj1、Cd24a和Acta2阳性的一类室管膜细胞亚群,但没有研究Notch1/Flt1阳性或Cspg4/Pdgfrb阳性室管膜细胞亚群。
因此,通过该单细胞RNA测序,室管膜细胞被分为Prom1+和Prom1-类,每类中又有3个主要亚群,即“内皮样细胞”(Flt1/Pecam1/Sox17/Nes/Notch1阳性);“Foxj1+室管膜细胞”(Foxj1/Sox2/Acta2/S100b/Cd24a阳性);“周细胞样细胞”(Pdgfrb/Cspg4/Vtn阳性)亚群,以及 2 个次要亚群,即“内皮-周细胞样细胞”(Flt1和Pdgfrb 双阳性)和“Foxj1-内皮样细胞”(Flt1 和 Foxj1 双阳性)。在 Prom1-类中,还有一小部分仅Vim+的群体。这11种亚群组成了97.7%的室管膜“EPE 细胞”。
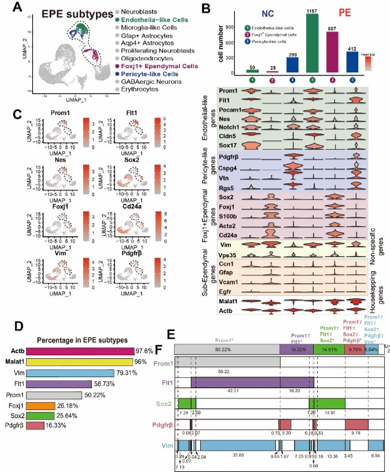
图3 单细胞RNA测序揭示室管膜细胞组成
为验证上述基于单细胞RNA测序的室管膜细胞亚群组成分析,孙毅等使用5种标记物Prom1 (CD133)、Sox2、Flt1、Pdgfrb和Vim对室管膜细胞进行了免疫染色。采用激光共聚焦显微镜z-stack方法(1 μm间隔)捕获纤毛和最外层室管膜细胞的免疫染色结果。收集了上3层的图像进行后续的定量分析。结果显示,室管膜细胞中67%为CD133+,49%为SOX2+,50%为FLT1+,16%为PDGFRβ+, 84%为VIM+(图4)。并且对不同亚群的重叠部分通过标志物双重染色或三重染色的手段进行了计算。最终,孙毅等用一个饼图,来阐明整个室管膜的综合细胞亚群组成:67.63%为CD133+多纤毛细胞,其中有5个主要亚组,即“内皮样细胞”(FLT1+),“Foxj1+内皮样细胞”(FLT1+/SOX2+),“Foxj1+室管膜细胞”(SOX2+),“周细胞样细胞”(PDGFRβ+)和“内皮-周细胞样细胞”(FLT1+/PDGFRβ+); 32.37%为CD133-,其中有6个主要亚组,即“内皮样细胞”,“Foxj1+室管膜细胞”,“Foxj1+内皮样细胞”,“周细胞样细胞”,“内皮-周细胞样细胞”,此外还有VIM+细胞和以上标志物均阴性的细胞。总的来说,这些细胞亚群构成了整个(100%)室管膜(图5)。
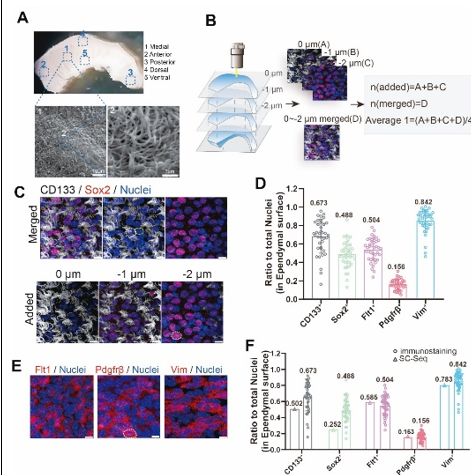
图4 对侧脑室侧壁进行免疫染色以验证室管膜的细胞组成
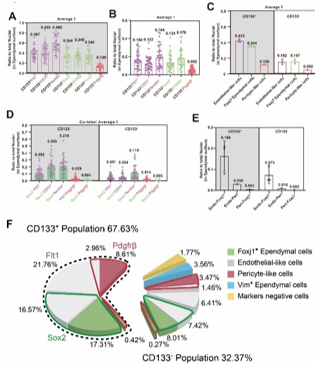
图5 室管膜的细胞亚型组成
总之,该研究首次全面分析了小鼠成年室管膜细胞亚型组成,由单细胞RNA测序指导,并通过免疫组织化学分析进行了验证和完善,最终对所有前脑室管膜细胞群进行了表征和量化。数据证实,成年小鼠室管膜细胞高度异质,包含至少12种不同的亚型,总体上分为67.63%的CD133+ (Prom1)群和32.37%的CD133-群。CD133+和CD133-室管膜细胞可进一步分为5个和7个亚群。这项研究的结果表明,先前关于成体室管膜细胞是否存在神经干细胞的两种观点是由于不同研究者关注了不同的室管膜细胞群。
研究也存在一定的局限性。由于单细胞RNA测序技术的mRNA捕获率相对较低(不到30%),假阴性是一个需要考虑的因素。且免疫组化分析只能用已知的标志物进行,并且也受到抗体质量(敏感性和特异性)以及计数方法的限制。孙毅等利用2种方法的互补完成了整个室管膜的细胞亚群组成研究。未来的谱系追踪研究需要使用双重或三重标记物标记(例如ProTracer [5]),以确定哪些室管膜亚型细胞具有成体神经干细胞特征。本研究的数据和细胞类型分析将作为进一步探究室管膜是否具有成体神经干细胞活性的基础。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00789
参考文献
[1] Ming GL, Song H. Adult neurogenesis in the mammalian central nervous system. Annu Rev Neurosci. 2005;28:223-250.
[2] Gage FH. Mammalian neural stem cells. Science. 2000;287(5457):1433-1438.
[3] Fuentealba LC, Rompani SB, Parraguez JI, et al. Embryonic origin of postnatal neural stem cells. Cell. 2015;161(7):1644-1655.
[4] Obernier K, Cebrian-Silla A, Thomson M, et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 2018;22(2):221-234.e228.
[5] He L, Pu W, Liu X, et al. Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science. 2021;371(6532):eabc4346.




