NRR:中国西南医科大学李经伦团队揭示抗炎多肽Chemerin 15可用于减轻脑缺血再灌注损伤
撰文:李霜,杨语涵,李堃毅,文岚,李经伦
脑卒中是全球致残和死亡的第二大原因,其中约87%是缺血性脑卒中[1]。神经炎症在缺血性脑卒中的病理生理发展中发挥重要作用,影响患者预后。小胶质细胞作为神经炎症的第一反应者,参与神经炎症发生发展的全过程,决定炎症的规模及进展。活化的小胶质细胞可极化为多种表型,主要为促炎表型(M1型)和抗炎表型(M2型)[2]。M1型小胶质细胞产生炎症因子并诱导组织损伤,阻碍中枢神经系统修复;而M2型小胶质细胞吞噬细胞碎片、缓解局部炎症、分泌生长因子和神经营养因子,发挥神经保护特性 [3, 4]。Chemerin15 (C15)是一种源自Chemerin的短肽,作为炎症解决介质中的重要成员,在外周炎症模型中通过ChemR23调节巨噬细胞极化,降低炎症细胞因子的表达,调节外周免疫细胞功能从而发挥抗炎作用。然而,目前尚不清楚C15对小胶质细胞及脑缺血再灌注损伤的影响及其潜在作用机制。
中国西南医科大学李经伦团队与成都医学院文岚团队合作,在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Chemerin
15 peptide reduces neuroinflammation via the ChemR23 receptor after
ischemia–reperfusion injury”的研究,使用体外氧糖剥夺模型,研究C15对小胶质细胞诱导的神经炎症及与小胶质细胞共培养神经元的影响;体内脑缺血再灌注损伤模型探索在缺血再灌注损伤后,C15对脑组织短期及长期的保护作用;并进一步探讨其潜在机制。发现抗炎多肽C15可促进小胶质细胞向M2表型转化,促进抗炎介质的分泌,保护神经元,缩小梗死体积,改善脑缺血再灌注损伤小鼠的长期预后。进一步研究表明,C15的这些作用可能通过与膜表面的受体ChemR23结合并诱导其内化,从而激活腺苷5′-单磷酸活化蛋白激酶(AMPK),抑制核因子κB(NF-κB)来实现。这项研究为脑缺血后应用C15解决炎症问题提供了初步证据,可能成为未来缺血性脑卒中新的治疗靶点。
在缺血性脑卒中的急性阶段,小胶质细胞迅速激活并聚集在损伤部位,并在免疫微环境下转变为促炎(M1)和/或保护(M2)表型,从而调控炎症反应的程度、时间和范围,以维持组织稳态。C15是来源于Chemerin的在炎症环境中不具有趋化作用,但具有强大抗炎作用的多肽 [5]。尽管在外周炎症模型及中枢和神经系统疾病模型中已证实C15具有抗炎作用,但在缺血性脑卒中未见报道。因此,结合既往文献,李经伦等合理推测C15可能调节小胶质细胞表型、影响炎症因子的分泌,从而减轻脑缺血再灌注损伤,改善长期预后。此次实验拟结合细胞与动物实验验证这一假设。研究首先发现C15促进体外培养的小胶质细胞向M2表型极化,促进抗炎介质(Arg-1和IL-10)的分泌,间接保护神经元(图1)。接下来,探索C15潜在的作用机制,发现C15与ChemR23受体结合并促进其内化,激活AMPK/NF-κB通路,这些变化可被α-NETA(ChemR23受体拮抗剂)逆转(图2)。最后探索C15对脑缺血再灌注损伤小鼠神经功能的短期和长期影响,结果表明C15在脑缺血再灌注损伤早期减轻神经元凋亡和梗死体积(图3),促进抗炎介质的分泌,并减轻长期神经功能缺损及认知功能障碍(图4)。这些结果表明,抗炎多肽C15可调节脑缺血后小胶质细胞反应性,促进炎症解决,从而保护神经元、减轻小鼠脑缺血损伤、改善预后。这可能发展为治疗脑缺血后神经炎症的一种新型疗法。
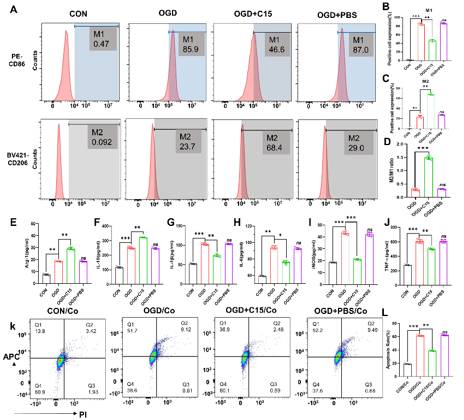
图1 C15可促进小胶质细胞极化为M2表型,增加抗炎因子(Arg-1和IL-10)的分泌,间接保护与小胶质细胞共培养的神经元
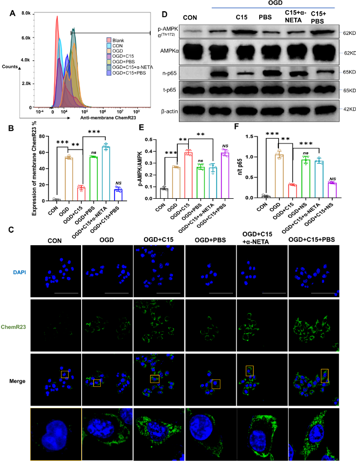
图2 C15可与ChemR23结合并促进其内化,调控AMPK/NF-κB信号通路
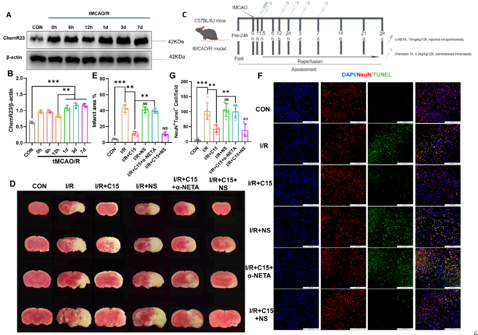
图3 C15在体内可通过ChemR23减轻神经元凋亡和梗死体积

图4 C15在体内可促进抗炎因子早期分泌并维持较高水平,减轻神经功能缺损
#br#
综上所述,C15通过调节小胶质细胞表型,促进抗炎因子分泌,促进炎症的消退,间接保护神经元,从而减轻神经功能缺损,改善长期预后。这些作用与ChemR23内化和AMPK/NF-κB信号通路有关,并证明了C15在预防脑缺血再灌注损伤中的潜在作用。
在这项研究中,李经伦等重点关注C15对脑缺血再灌注小胶质细胞的抗炎和神经保护作用,但ChemR23也在其他神经细胞(如星形胶质细胞)和浸润性外周免疫细胞中表达,因此,C15对其它神经细胞的作用及其相互作用仍有待充分研究。此外,实验仅提供了C15在脑缺血再灌注损伤中的初步证据,为未来抗炎策略的开发提供了一些思路。但临床应用仍有较大挑战,后续研究应进一步探讨该药物的安全性及生物利用度,以及如何靶向递送等问题。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00137
参考文献
#br#
[1] Saini V, Guada L, Yavagal DR. Global Epidemiology of Stroke and Access to Acute Ischemic Stroke Interventions. Neurology. 2021;97(20 Suppl 2):S6-S16.
[2] Zhong X, Liu M, Yao W, et al. Epigallocatechin-3-Gallate Attenuates Microglial Inflammation and Neurotoxicity by Suppressing the Activation of Canonical and Noncanonical Inflammasome via TLR4/NF-κB Pathway. Mol Nutr Food Res. 2019;63(21):e1801230.
[3] Zhang Y, Anoopkumar-Dukie S, Mallik SB, et al. SIRT1 and SIRT2 modulators reduce LPS-induced inflammation in HAPI microglial cells and protect SH-SY5Y neuronal cells in vitro. J Neural Transm (Vienna). 2021;128(5):631-644.
[4] Baxter PS, Dando O, Emelianova K, et al. Microglial identity and inflammatory responses are controlled by the combined effects of neurons and astrocytes. Cell Rep. 2021;34(12):108882.
[5] Cash JL, Hart R, Russ A, et al. Synthetic chemerin-derived peptides suppress inflammation through ChemR23. J Exp Med. 2008;205(4):767-775.



