中国神经再生研究(英文版) ›› 2024, Vol. 19 ›› Issue (9): 1947-1953.doi: 10.4103/1673-5374.390961
靶向星形胶质细胞及其来源的靶向其他类型细胞外泌体的功能
-
出版日期:2024-09-15发布日期:2024-01-25 -
基金资助:国家自然科学基金项目(82071278);长海医院优秀青年医学人才项目(2021JCSQ03);上海市扬帆项目(20YF1448000);舟山市医疗卫生科技项目(2022JRC01)
The functions of exosomes targeting astrocytes and astrocyte-derived exosomes targeting other cell types
Hongye Xu1, #, He Li1, 2, #, Ping Zhang1, #, Yuan Gao1, Hongyu Ma1, Tianxiang Gao1, Hanchen Liu1, Weilong Hua1, Lei Zhang1, Xiaoxi Zhang1, *, Pengfei Yang1, *, Jianmin Liu1
- 1Neurovascular Center, Changhai Hospital, Naval Medical University, Shanghai, China; 2Department of Emergency, Naval Hospital of Eastern Theater, Zhoushan, Zhejiang Province, China
-
Online:2024-09-15Published:2024-01-25 -
Contact:Xiaoxi Zhang, MD, 18801765148@163.com; Pengfei Yang, MD, chyangpf@.163.com. -
Supported by:This work was supported by the National Natural Science Foundation of China, No. 82071278 (to PY); Outstanding Young Medical Talents Project of Changhai Hospital, No. 2021JCSQ03 (to PY), Shanghai Sailing Program, No. 20YF1448000 (to XZ), and Medical Health Science and Technology Project of Zhoushan City, No. 2022JRC01 (to HL).
摘要:
星形胶质细胞是中枢神经系统中最丰富的神经胶质细胞,可参与维持大脑结构和调节神经系统功能的重要生物过程。外泌体是细胞来源的细胞外囊泡,含有从细胞分泌的各种生物活性分子,如蛋白、多肽、核苷酸和脂质。越来越多的证据表明,外泌体在神经系统中构成了一个通信网络,而星形胶质细胞来源的外泌体在此网络中发挥着重要的作用。此次综述总结了靶向星形胶质细胞的外泌体,以及星形胶质细胞来源的靶向其他类型细胞的外泌体的作用,并对基于外泌体的通信网络的潜在研究方向进行展望。这项综述得出以星形胶质细胞为重点的基于外泌体的细胞间通信对大脑不同条件下的生物学或病理过程具有重要意义。
https://orcid.org/0000-0003-3937-407X (Xiaoxi Zhang); https://orcid.org/0000-0002-6154-3602 (Pengfei Yang)
引用本文
. 靶向星形胶质细胞及其来源的靶向其他类型细胞外泌体的功能[J]. 中国神经再生研究(英文版), 2024, 19(9): 1947-1953.
Hongye Xu, He Li, Ping Zhang, Yuan Gao, Hongyu Ma, Tianxiang Gao, Hanchen Liu, Weilong Hua, Lei Zhang, Xiaoxi Zhang, Pengfei Yang, Jianmin Liu. The functions of exosomes targeting astrocytes and astrocyte-derived exosomes targeting other cell types[J]. Neural Regeneration Research, 2024, 19(9): 1947-1953.
| [1] | . 高表达miR-124-3p小胶质细胞源性外泌体可减轻重复性轻度创伤性脑损伤后神经元内质网应激损伤[J]. 中国神经再生研究(英文版), 2024, 19(9): 2010-2018. |
| [2] | . 神经胶质细胞的神经元转分化:缺失神经元补充策略[J]. 中国神经再生研究(英文版), 2024, 19(7): 1446-1453. |
| [3] | . 近红外脑功能成像技术与非侵入性神经调控技术[J]. 中国神经再生研究(英文版), 2024, 19(7): 1517-1522. |
| [4] | . 负载人脐带间充质干细胞外泌体的复合支架修复长距离周围神经缺损[J]. 中国神经再生研究(英文版), 2024, 19(4): 900-907. |
| [5] | . CD36在中枢神经系统疾病中的作用 [J]. 中国神经再生研究(英文版), 2024, 19(3): 512-518. |
| [6] | . 感觉运动皮质缺血后皮质脊髓束Wallerian变性的可视化[J]. 中国神经再生研究(英文版), 2024, 19(3): 636-641. |
| [7] | 宋兴爽, Yizhi Zhang, Ziyan Tang, 杜丽娜. 纳米载体应用在创伤性脑损伤基础研究中的优势[J]. 中国神经再生研究(英文版), 2024, 19(2): 237-245. |
| [8] | . 细胞外囊泡联合疗法治疗脊髓损伤:更有效果的证据[J]. 中国神经再生研究(英文版), 2024, 19(2): 369-374. |
| [9] | . 阿加曲班可抑制损伤脊髓恢复的PAR1/JAK2/STAT3信号通路[J]. 中国神经再生研究(英文版), 2024, 19(2): 434-439. |
| [10] | . 5-羟色胺:肌萎缩侧索硬化的潜在干预靶点[J]. 中国神经再生研究(英文版), 2023, 18(9): 2047-2055. |
| [11] | . 鞘氨醇-1-磷酸受体1 可调节癫痫小鼠血脑屏障的通透性[J]. 中国神经再生研究(英文版), 2023, 18(8): 1763-1769. |
| [12] | . 小胶质细胞或星形胶质细胞通过MER原癌激酶介导创伤性脑损伤后的突触吞噬[J]. 中国神经再生研究(英文版), 2023, 18(8): 1770-1776. |
| [13] | . 脑卒中后亚急性期抑制Notch信号可促进纹状体星形胶质细胞转化为神经元[J]. 中国神经再生研究(英文版), 2023, 18(8): 1777-1781. |
| [14] | . 运动训练联合骨髓间充质干细胞来源外泌体减少神经元凋亡和轴突重塑具有协同作用[J]. 中国神经再生研究(英文版), 2023, 18(6): 1293-1299. |
| [15] | . 凝血酶可促进脊髓损伤后胆固醇25-羟化酶在星形胶质细胞中的表达[J]. 中国神经再生研究(英文版), 2023, 18(6): 1339-1346. |
出版重点
《中国神经再生研究(英文版)》杂志为SCI、PubMed数据库收录的国际唯一一本专注神经再生领域研究的经同行评议的开放获取期刊,出版来自全球神经再生领域专业学者的前沿性基础研究及临床研究及转化医学、循证医学优秀的最新成果。
期刊出版来自于脑损伤与神经再生、脊髓损伤与神经再生、周围神经损伤与神经再生和神经退行性病与神经再生、神经影像与神经再生的相关研究。期刊关注神经损伤与再生过程中的轴突再生、突触生长、神经可塑性、神经修复和替代、神经移植等最新研究成果。尤其关注应用细胞治疗、基因治疗、生物因子治疗、药物治疗、手术治疗、康复治疗、物理疗法、组织工程、生物工程、生物材料、神经假体等干预性方法产生神经再生效果的相关研究。文章应清晰描述抑制神经元损伤、减轻神经元损伤的一系列变化,保护损伤神经元的过程、方法、程度与评价,突出从细胞分子水平以及分子生物学水平解释神经元损伤后以及预后再生的机制。
NRR杂志被国际重要数据库收录
科学引文索引(Science Citation Index Expanded,SCI)
美国国立医学图书馆(PubMed)
美国国立医学图书馆开放获取全文数据库(PubMed Central, PMC)
美国生物学文摘数据库(BIOSIS previews, BP)
美国《化学文摘》(Chemical Abstracts, CA)
Scopus荷兰《医学文摘库/医学文摘》(Excerpta Medica, EM)
波兰《哥伯尼索引》(Index of Copurnicus, IC)
OvidSP平台数据库
中国科学引文数据库(CSCD)
中国科技期刊数据库-统计源期刊(CSTPCD)
编委会
主编Editor-in-Chief
苏国辉院士(Kwok-fai So, Chair Professor and Head, Jessie Ho Professor in Neuroscience, Department of Anatomy, The University of Hong Kong)。
徐晓明教授(Xiao-ming Xu, Professor and Mari Hulman George Chair of Neurological Surgery, Scientific Director of Spinal Cord and Brain Injury Research Group, Indiana University School of Medicine)
联系方式:Email: szb@nrren.org 电话:+86 138 0499 8773
编委会成员
期刊编委队伍由国际神经再生领域著名学者、中国科学院院士、香港大学苏国辉教授和美国印第安纳大学徐晓明教授领导的由100多位国际神经再生优秀专家组成。共同致力于创办一本发表神经再生领域专业学术研究经同行严格评审的优秀学术期刊。
在线投稿平台
作者可以通过www.nrronline.org在线投稿。
所有的稿件都将通过该系统提交至NRR杂志电子投稿出版管理系统。
作者有不明确的问题,请访问szb@nrren.org或咨询+86 138 0499 8773。
投稿后,当论文已处于审稿或等待审稿状态时,2个月内请勿将稿件再投至他刊。
初次投稿:
投稿信:
应说明文章未一稿多投,全部作者是否对所投稿件内容知情同意,推荐2-3位小同行审稿人。
作者协议:
投稿时请注意作者协议,如同意后可继续完成投稿, 投稿成功后作者已与杂志签定了文章的相关版权。
投稿后的同行评议
期刊投稿平台应用国际最大的投稿平台Editorial Manager,投到本刊的每篇稿件都要经过3-4位小同行审稿人评审,审稿方法为国际学科小同行组成双盲审稿。所有发表在杂志的文章都将经过严格的双盲同行层层评议,审稿中注重科学性、伦理学和文章真实性的严格审查。期刊将在投稿后4周内通知作者评审意见。
根据评审意见,编辑部决定稿件返修,再审,被接受或退稿。 稿件被接受后,作者可经投稿平台以通讯作者账号随时查询稿件的出版进程。
出版时间
一般稿件被采用后3-4个月出版,优秀文章可在被采用后1-2个月内发表,有临床试验注册号的优秀临床试验文章可申请加急发表。
出版后传播
文章出版后将在EurekAlert!和EurekAlert!中文新闻平台以中英文双语形式向全世界同仁传播。EurekAlert!和EurekAlert!中文新闻平台是美国科学促进会(AAAS)主办的一项全球的科学新闻服务。美国科学促进会为世界最大的科学协会,并且是《科学》杂志的出版机构。您的文章将以最快时间推送给经严格验证的来自全球的新闻记者8000余人,包括来自国际的纽约时报、华盛顿邮报和路透社等,来自中国的中国日报、新华社、人民日报等国际主流媒体,为科学家们提供了与国际科学记者和国际学术平台直接沟通的一个快速有效的桥梁。我们将随后为您提供您新闻的网站点击情况和媒体报告情况的具体数据。
出版后的新闻传播将极大提高文章的影响力,统计同时表明发布学术新闻的文章将提高其被引率70%以上。
杂志的读者群Audience
来自全球从事神经再生、神经科学、神经解剖、神经病理、神经外科、神经内科、神经生物、神经影像、神经放射、神经康复等领域的学科专家。
对特邀综述稿件的要求:
(1)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(2)全文不超过6000个单词,包括摘要,不包括参考文献,图和表格 ,出版后8-10个版面。
(3)文章写作结构:
文题:不超过 90个字母,20个单词。
摘要:非结构式, 250单词。
引言:
主体内容:
总结:
作者贡献:
利益冲突:
参考文献:采用 Journal of Neuroscience格式。
特邀述评类文章:观点、点评 、研究亮点、给编辑的信等。
特邀观点栏目文章要求:
(1)观点文章为作者对神经再生领域某一热点问题 的评论,有作者鲜明的观点和作者本人
对此科研过程的认识 和总结。
(2)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(3)全文2000- 3000单词,包括参考文献,不需要图和表格,不需要摘要,出 版后2个版面。
(4)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
特邀点评与研究亮点栏目文章 要求:
(1)点评文章为点评在本刊发表的文章,研究亮点 文章为点评国际优秀杂志近期或在线提前发表的前沿性的优秀文章。
(2)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(3)全文2000- 3000单词,包括参考文献,不需要图和表格,不需要摘要,出 版后2个版面。
(4)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
利益冲突:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
给编辑的信栏目文章要求:
(1)给编辑的信文章为读者对本刊已发表文章的来 信反馈。
(2)全文1000- 2000单词,不包括参考文献,文章不需要摘要、图和表格,出 版后1个版面。
(4)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
利益冲突:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
如果您需要向SCI收录期刊投稿,我们可以为您提供如下服务--
NRR:将星形胶质细胞置于外泌体“网络”中心:海军军医大学杨鹏飞教授团队发表的一项最新综述
撰文:许宏业
星形胶质细胞是中枢神经系统中分布最广泛的神经胶质细胞,也是关键的调节和支持细胞。研究表明,星形胶质细胞可以分为多种亚群,在不同条件或疾病中表现出特定的功能[1-4]。外泌体是细胞外囊泡的一个亚类,其通过运输包括核酸、蛋白质和脂质在内的生物成分,广泛参与各种生物过程和细胞间通信的调节[5, 6]。近年来,外泌体在中枢神经系统中的功能越来越受到研究者的关注。来自神经元、小胶质细胞、星形胶质细胞、少突胶质细胞和神经干细胞的外泌体的功能逐渐被揭示。星形胶质细胞作为中枢神经系统中最重要的支持细胞之一,在不同条件下分泌含有多种成分的外泌体,还接受来自其他细胞的外泌体,相应地改变它们的功能和表型。#br# 最近中国海军军医大学长海医院杨鹏飞教授团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)上发表了题为“The functions of exosomes targeting astrocytes and astrocyte-derived exosomes targeting other cell types”的综述。该文将星形胶质细胞置于外泌体“网络”的中心,系统性地总结了靶向星形胶质细胞的外泌体,以及星形胶质细胞来源的靶向其他类型细胞的外泌体的作用机制,并对如何研究星形胶质细胞在这个“网络”中的作用提出了新的展望。#br# #br# 杨鹏飞等总结了基于星形胶质细胞的基于外泌体的细胞间通信(图1)。来自干细胞、神经元、免疫细胞、恶性细胞、嗅鞘细胞、雪旺细胞和内皮细胞的外泌体可影响星形胶质细胞的功能(表1)。相反,星形胶质细胞来源的外泌体可以影响其他细胞的功能,包括神经元、小胶质细胞、少突胶质细胞、恶性细胞等(表2)。
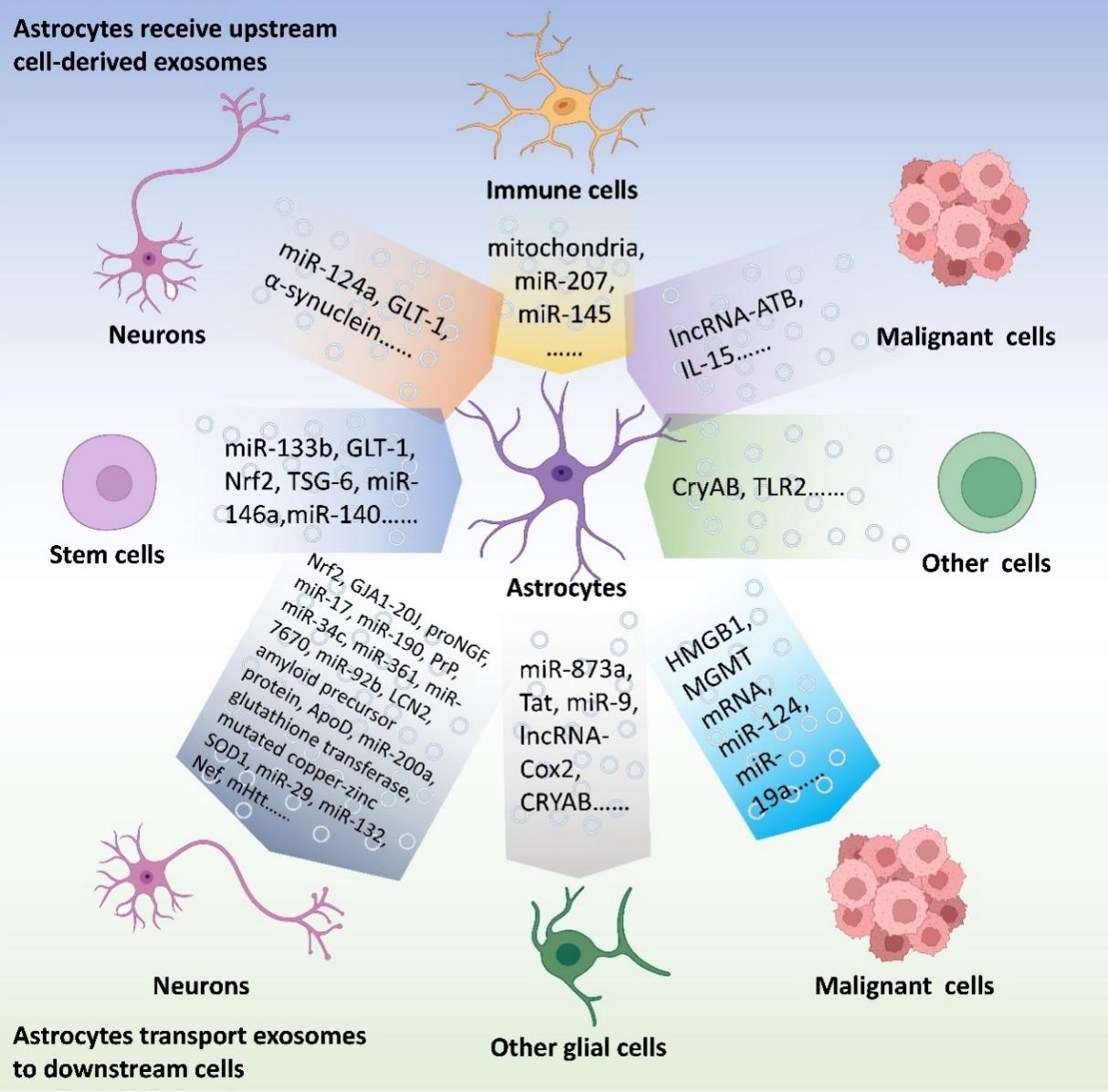
图1基于外泌体的细胞间通讯:聚焦星形胶质细胞(图源:Xu et al., Neural Regen Res, 2024)
以星形胶质细胞为中心的基于外泌体的细胞间通信是中枢神经系统实验研究中有价值的研究目标[1]。星形胶质细胞作为中枢神经系统的主要细胞类型,被认为是中枢神经系统外泌体的主要来源和关键受体。在中枢神经系统,他们在填补神经元之间的空白、维持稳态、参与血脑屏障的形成、修复受伤的脑组织中发挥关键作用。因此,星形胶质细胞成为外泌体的有意义的靶点和来源。#br# 目前外泌体中的生物成分是研究热点,主要取决于它们的来源细胞和施加在这些细胞上的干预条件。以星形胶质细胞为例,在氧糖剥夺再灌注或炎症刺激下,其外泌体可能对神经元发挥保护作用[44, 60];而在淀粉样蛋白β刺激下和人免疫缺陷病毒感染后,星形胶质细胞来源的外泌体可能加剧神经元的损伤[47, 51]。此外,研究发现外泌体是一个网络,而不是从一个细胞到另一个细胞的一条线。星形胶质细胞接收到来自小胶质细胞、神经元、干细胞,甚至是恶性细胞的外泌体,而来自星形胶质细胞的外泌体也会影响中枢神经系统中的多种细胞类型。因此,我们应该在特定的条件下,将星形胶质细胞放入整个基于外泌体的细胞间通信网络中。
近年来,出现了一些新的技术来研究不同组织中外泌体的细胞来源。掌握外泌体的细胞来源的最简单的方法是检测组织来源的外泌体中不同细胞的标记物的水平[68]。Liu等[69]的方法可以更好地显示每个细胞中组织来源的外泌体的百分比。该方法将单细胞RNA测序中确定的每个细胞簇的“簇制造者”与从蛋白质质谱仪中得到的外泌体蛋白列表重叠。然后,通过算法匹配外泌体蛋白列表中每个蛋白质的比例和每个细胞中编码该蛋白的基因的转录水平,以确定组织来源的外泌体的细胞来源。Wu等[70]的方法为研究人员提供了分析单个外泌体上的表面蛋白的机会。他们报道了一种被称为接近依赖条形码分析的新方法。简单地说,他们认为每个外泌体都有一个条形码,每个外泌体的表面蛋白质也被标记出来。该方法可以更好地分析组织来源的外泌体的细胞来源。通过这些新方法,星形胶质细胞来源的外泌体的作用可在大脑中基于外泌体的细胞间通信的背景下进行单独的研究。此外,还可以使用更先进的成像平台实时检测外泌体释放,通过高通量筛选和计算机辅助药物设计平台设计靶向星形胶质细胞的工程化外泌体[71-73]。
原文链接:https://doi.org/10.4103/1673-5374.390961
参考文献
[1] Zhou B, Zuo YX, Jiang RT. Astrocyte morphology: diversity, plasticity, and role in neurological diseases. CNS Neurosci Ther. 2019;25(6):665-673.
[2] Sofroniew MV. Astrocyte reactivity: subtypes, states, and functions in CNS innate immunity. Trends Immunol. 2020;41(9):758-770.
[3] Freeman MR. Specification and morphogenesis of astrocytes. Science. 2010;330(6005):774-778.
[4] Sontheimer H. Voltage-dependent ion channels in glial cells. Glia. 1994;11(2):156-172.
[5] Mathivanan S, Ji H, Simpson RJ. Exosomes: extracellular organelles important in intercellular communication. J Proteomics. 2010;73(10):1907-1920.
[6] Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 2014;30:255-289.
[7] Pan D, Li Y, Yang F, et al. Increasing toll-like receptor 2 on astrocytes induced by Schwann cell-derived exosomes promotes recovery by inhibiting CSPGs deposition after spinal cord injury. J Neuroinflammation. 2021;18(1):172.
[8] Saglam A, Calof AL, Wray S. Novel factor in olfactory ensheathing cell-astrocyte crosstalk: Anti-inflammatory protein α-crystallin B. Glia. 2021;69(4):1022-1036.
[9] Tseng AM, Chung DD, Pinson MR, et al. Ethanol exposure increases miR-140 in extracellular vesicles: implications for fetal neural stem cell proliferation and maturation. Alcohol Clin Exp Res. 2019;43(7):1414-1426.
[10] Sun X, Jung JH, Arvola O, et al. Stem cell-derived exosomes protect astrocyte cultures from in vitro ischemia and decrease injury as post-stroke intravenous therapy. Front Cell Neurosci. 2019;13:394.
[11] Li D, Wang Y, Jin X, et al. NK cell-derived exosomes carry miR-207 and alleviate depression-like symptoms in mice. J Neuroinflammation. 2020;17(1):126.
[12] Morel L, Regan M, Higashimori H, et al. Neuronal exosomal miRNA-dependent translational regulation of astroglial glutamate transporter GLT1. J Biol Chem. 2013;288(10):7105-7116.
[13] Jiang D, Gong F, Ge X, et al. Neuron-derived exosomes-transmitted miR-124-3p protect traumatically injured spinal cord by suppressing the activation of neurotoxic microglia and astrocytes. J Nanobiotechnology. 2020;18(1):105.
[14] Song H, Zhang X, Chen R, et al. Cortical neuron-derived exosomal microRNA-181c-3p inhibits neuroinflammation by downregulating CXCL1 in astrocytes of a rat model with ischemic brain injury. Neuroimmunomodulation. 2019;26(5):217-233.
[15] Meng Y, Ding J, Li C, et al. Transfer of pathological α-synuclein from neurons to astrocytes via exosomes causes inflammatory responses after METH exposure. Toxicol Lett. 2020;331:188-199.
[16] Ye Y, Hao J, Hong Z, et al. Downregulation of MicroRNA-145-5p in Activated Microglial Exosomes Promotes Astrocyte Proliferation by Removal of Smad3 Inhibition. Neurochem Res. 2022;47(2):382-393.
[17] Huo Q, Shi Y, Qi Y, et al. Biomimetic silibinin-loaded macrophage-derived exosomes induce dual inhibition of Aβ aggregation and astrocyte activation to alleviate cognitive impairment in a model of Alzheimer's disease. Mater Sci Eng C Mater Biol Appl. 2021;129:112365.
[18] Liu W, Su C, Qi Y, et al. Brain-targeted heptapeptide-loaded exosomes attenuated ischemia-reperfusion injury by promoting the transfer of healthy mitochondria from astrocytes to neurons. J Nanobiotechnology. 2022;20(1):242.
[19] Bian EB, Chen EF, Xu YD, et al. Exosomal lncRNA ATB activates astrocytes that promote glioma cell invasion. Int J Oncol. 2019;54(2):713-721.
[20] Halurkar MS, Wang J, Chen S, et al. EPC-EXs improve astrocyte survival and oxidative stress through different uptaking pathways in diabetic hypoxia condition. Stem Cell Res Ther. 2022;13(1):91.
[21] Perez-Corredor PA, Oluwatomilayo-Ojo P, Gutierrez-Vargas JA, et al. Obesity induces extracellular vesicle release from the endothelium as a contributor to brain damage after cerebral ischemia in rats. Nutr Neurosci. 2023;26(8):680-695.
[22] Tang B, Song M, Xie X, et al. Tumor necrosis factor-stimulated gene-6 (TSG-6) secreted by BMSCs regulates activated astrocytes by inhibiting NF-κB signaling pathway to ameliorate blood brain barrier damage after intracerebral hemorrhage. Neurochem Res. 2021;46(9):2387-2402.
[23] Kubota K, Nakano M, Kobayashi E, et al. An enriched environment prevents diabetes-induced cognitive impairment in rats by enhancing exosomal miR-146a secretion from endogenous bone marrow-derived mesenchymal stem cells. PLoS One. 2018;13(9):e0204252.
[24] Cui L, Luo W, Jiang W, et al. Human umbilical cord mesenchymal stem cell-derived exosomes promote neurological function recovery in rat after traumatic brain injury by inhibiting the activation of microglia and astrocyte. Regen Ther. 2022;21:282-287.
[25] Fan L, Liu C, Chen X, et al. Exosomes-loaded electroconductive hydrogel synergistically promotes tissue repair after spinal cord injury via immunoregulation and enhancement of myelinated axon growth. Adv Sci (Weinh). 2022;9(13):e2105586.
[26] Kinjyo I, Bragin D, Grattan R, et al. Leukemia-derived exosomes and cytokines pave the way for entry into the brain. J Leukoc Biol. 2019;105(4):741-753.
[27] Xin H, Li Y, Buller B, et al. Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth. Stem Cells. 2012;30(7):1556-1564.
[28] Xin H, Wang F, Li Y, et al. Secondary release of exosomes from astrocytes contributes to the increase in neural plasticity and improvement of functional recovery after stroke in rats treated with exosomes harvested from microRNA 133b-overexpressing multipotent mesenchymal stromal cells. Cell Transplant. 2017;26(2):243-257.
[29] Nakano M, Nagaishi K, Konari N, et al. Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes. Sci Rep. 2016;6:24805.
[30] Zhuang Z, Liu M, Luo J, et al. Exosomes derived from bone marrow mesenchymal stem cells attenuate neurological damage in traumatic brain injury by alleviating glutamate-mediated excitotoxicity. Exp Neurol. 2022;357:114182.
[31] Wang L, Pei S, Han L, et al. Mesenchymal stem cell-derived exosomes reduce A1 astrocytes via downregulation of phosphorylated NFκB P65 subunit in spinal cord injury. Cell Physiol Biochem. 2018;50(4):1535-1559.
[32] Chen SY, Lin MC, Tsai JS, et al. EP(4) antagonist-elicited extracellular vesicles from mesenchymal stem cells rescue cognition/learning deficiencies by restoring brain cellular functions. Stem Cells Transl Med. 2019;8(7):707-723.
[33] Liu K, Cai GL, Zhuang Z, et al. Interleukin-1β-treated mesenchymal stem cells inhibit inflammation in hippocampal astrocytes through exosome-activated Nrf-2 signaling. Int J Nanomedicine. 2021;16:1423-1434.
[34] Basso M, Pozzi S, Tortarolo M, et al. Mutant copper-zinc superoxide dismutase (SOD1) induces protein secretion pathway alterations and exosome release in astrocytes: implications for disease spreading and motor neuron pathology in amyotrophic lateral sclerosis. J Biol Chem. 2013;288(22):15699-15711.
[35] Silverman JM, Christy D, Shyu CC, et al. CNS-derived extracellular vesicles from superoxide dismutase 1 (SOD1)(G93A) ALS mice originate from astrocytes and neurons and carry misfolded SOD1. J Biol Chem. 2019;294(10):3744-3759.
[36] Xu Y, Tian Y, Wang Y, et al. Exosomes derived from astrocytes after oxygen-glucose deprivation promote differentiation and migration of oligodendrocyte precursor cells in vitro. Mol Biol Rep. 2021;48(7):5473-5484.
[37] Zhang W, Hong J, Zhang H, et al. Astrocyte-derived exosomes protect hippocampal neurons after traumatic brain injury by suppressing mitochondrial oxidative stress and apoptosis. Aging (Albany NY). 2021;13(17):21642-21658.
[38] Chen W, Zheng P, Hong T, et al. Astrocytes-derived exosomes induce neuronal recovery after traumatic brain injury via delivering gap junction alpha 1-20 k. J Tissue Eng Regen Med. 2020;14(3):412-423.
[39] Cheng YY, Zhao HK, Chen LW, et al. Reactive astrocytes increase expression of proNGF in the mouse model of contused spinal cord injury. Neurosci Res. 2020;157:34-43.
[40] Du L, Jiang Y, Sun Y. Astrocyte-derived exosomes carry microRNA-17-5p to protect neonatal rats from hypoxic-ischemic brain damage via inhibiting BNIP-2 expression. Neurotoxicology. 2021;83:28-39.
[41] Pei X, Li Y, Zhu L, et al. Astrocyte-derived exosomes transfer miR-190b to inhibit oxygen and glucose deprivation-induced autophagy and neuronal apoptosis. Cell Cycle. 2020;19(8):906-917.
[42] Guitart K, Loers G, Buck F, et al. Improvement of neuronal cell survival by astrocyte-derived exosomes under hypoxic and ischemic conditions depends on prion protein. Glia. 2016;64(6):896-910.
[43] Wu W, Liu J, Yang C, et al. Astrocyte-derived exosome-transported microRNA-34c is neuroprotective against cerebral ischemia/reperfusion injury via TLR7 and the NF-κB/MAPK pathways. Brain Res Bull. 2020;163:84-94.
[44] Chen W, Wang H, Zhu Z, et al. Exosome-shuttled circSHOC2 from IPASs regulates neuronal autophagy and ameliorates ischemic brain injury via the miR-7670-3p/SIRT1 axis. Mol Ther Nucleic Acids. 2020;22:657-672.
[45] Hira K, Ueno Y, Tanaka R, et al. Astrocyte-derived exosomes treated with a semaphorin 3A inhibitor enhance stroke recovery via prostaglandin D(2) synthase. Stroke. 2018;49(10):2483-2494.
[46] Liu R, Wang J, Chen Y, et al. NOX activation in reactive astrocytes regulates astrocytic LCN2 expression and neurodegeneration. Cell Death Dis. 2022;13(4):371.
[47] Wu Q, Cortez L, Kamali-Jamil R, et al. Implications of exosomes derived from cholesterol-accumulated astrocytes in Alzheimer's disease pathology. Dis Model Mech. 2021;14(10):dmm048929.
[48] Deng Z, Wang J, Xiao Y, et al. Ultrasound-mediated augmented exosome release from astrocytes alleviates amyloid-β-induced neurotoxicity. Theranostics. 2021;11(9):4351-4362.
[49] Pascua-Maestro R, González E, Lillo C, et al. Extracellular vesicles secreted by astroglial cells transport apolipoprotein D to neurons and mediate neuronal survival upon oxidative stress. Front Cell Neurosci. 2018;12:526.
[50] Shakespear N, Ogura M, Yamaki J, et al. Astrocyte-derived exosomal microRNA miR-200a-3p prevents MPP(+)-induced apoptotic cell death through down-regulation of MKK4. Neurochem Res. 2020;45(5):1020-1033.
[51] Hu G, Yao H, Chaudhuri AD, et al. Exosome-mediated shuttling of microRNA-29 regulates HIV Tat and morphine-mediated neuronal dysfunction. Cell Death Dis. 2012;3(8):e381.
[52] Rahimian P, He JJ. HIV-1 Tat-shortened neurite outgrowth through regulation of microRNA-132 and its target gene expression. J Neuroinflammation. 2016;13(1):247.
[53] Pužar Dominkuš P, Ferdin J, Plemenitaš A, et al. Nef is secreted in exosomes from Nef.GFP-expressing and HIV-1-infected human astrocytes. J Neurovirol. 2017;23(5):713-724.
[54] Goetzl EJ, Schwartz JB, Abner EL, et al. High complement levels in astrocyte-derived exosomes of Alzheimer disease. Ann Neurol. 2018;83(3):544-552.
[55] Goetzl EJ, Yaffe K, Peltz CB, et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB J. 2020;34(2):3359-3366.
[56] Patel MR, Weaver AM. Astrocyte-derived small extracellular vesicles promote synapse formation via fibulin-2-mediated TGF-β signaling. Cell Rep. 2021;34(10):108829.
[57] Venturini A, Passalacqua M, Pelassa S, et al. Exosomes from astrocyte processes: signaling to neurons. Front Pharmacol. 2019;10:1452.
[58] Chen Y, Xia K, Chen L, et al. Increased interleukin-6 levels in the astrocyte-derived exosomes of sporadic amyotrophic lateral sclerosis patients. Front Neurosci. 2019;13:574.
[59] Hong Y, Zhao T, Li XJ, et al. Mutant huntingtin inhibits αB-crystallin expression and impairs exosome secretion from astrocytes. J Neurosci. 2017;37(39):9550-9563
[60] Long X, Yao X, Jiang Q, et al. Astrocyte-derived exosomes enriched with miR-873a-5p inhibit neuroinflammation via microglia phenotype modulation after traumatic brain injury. J Neuroinflammation. 2020;17(1):89.
[61] Yang L, Niu F, Yao H, et al. Exosomal miR-9 released from HIV Tat stimulated astrocytes mediates microglial migration. J Neuroimmune Pharmacol. 2018;13(3):330-344.
[62] Hu G, Liao K, Niu F, et al. Astrocyte EV-induced lincRNA-Cox2 regulates microglial phagocytosis: implications for morphine-mediated neurodegeneration. Mol Ther Nucleic Acids. 2018;13:450-463.
[63] Guo YS, Liang PZ, Lu SZ, et al. Extracellular αB-crystallin modulates the inflammatory responses. Biochem Biophys Res Commun. 2019;508(1):282-288.
[64] Berrout J, Kyriakopoulou E, Moparthi L, et al. TRPA1-FGFR2 binding event is a regulatory oncogenic driver modulated by miRNA-142-3p. Nat Commun. 2017;8(1):947.
[65] Ma C, Chen H, Zhang S, et al. Exosomal and extracellular HMGB1 have opposite effects on SASH1 expression in rat astrocytes and glioma C6 cells. Biochem Biophys Res Commun. 2019;518(2):325-330.
[66] Yu T, Wang X, Zhi T, et al. Delivery of MGMT mRNA to glioma cells by reactive astrocyte-derived exosomes confers a temozolomide resistance phenotype. Cancer Lett. 2018;433:210-220.
[67] Segura-Aguilar J, Mannervik B, Inzunza J, et al. Astrocytes protect dopaminergic neurons against aminochrome neurotoxicity. Neural Regen Res. 2022;17(9):1861-1866.
[68] Brenna S, Altmeppen HC, Mohammadi B, et al. Characterization of brain-derived extracellular vesicles reveals changes in cellular origin after stroke and enrichment of the prion protein with a potential role in cellular uptake. J Extracell Vesicles. 2020;9(1):1809065.
[69] Liu B, Jin Y, Yang J, et al. Extracellular vesicles from lung tissue drive bone marrow neutrophil recruitment in inflammation. J Extracell Vesicles. 2022;11(5):e12223.
[70] Wu D, Yan J, Shen X, et al. Profiling surface proteins on individual exosomes using a proximity barcoding assay. Nat Commun. 2019;10(1):3854.
[71] Wevers NR, Kasi DG, Gray T, et al. A perfused human blood-brain barrier on-a-chip for high-throughput assessment of barrier function and antibody transport. Fluids Barriers CNS. 2018;15(1):23.
[72] Salman MM, Al-Obaidi Z, Kitchen P, et al. Advances in applying computer-aided drug design for neurodegenerative diseases. Int J Mol Sci. 2021;22(9):4688.
[73] Aldewachi H, Al-Zidan RN, Conner MT, et al. High-throughput screening platforms in the discovery of novel drugs for neurodegenerative diseases. Bioengineering (Basel). 2021;8(2):30.
许宏业、李翯、张萍为论文共同第一作者,张小曦和杨鹏飞为论文共同通讯作者。
杨鹏飞,主任医师,教授,博士生导师,海军军医大学第一附属医院(上海长海医院)脑血管病中心执行主任,担任国家脑防委中青年专家委员会副秘书长,中华医学会神经外科分会青年委员,中国卒中学会神经介入分会青年委员等,入选国家万人计划青年拔尖人才、上海市青年拔尖人才、浦江计划、卫健委优青和晨光计划等人才计划,荣获国家脑防委脑卒中防治优秀中青年专家,王忠诚中国神经外科医师青年奖等荣誉,担任NEJM和LANCET等SCI杂志审稿人。发表学术论文180余篇,SCI收录80余篇,代表性论著发表于NEJM和LANCET杂志。第一负责人主持国家及省部级课题11项,获得省部级一等奖4项。
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||