NRR:中国华中科技大学同济医学院附属同济医院舒凯康慧聪团队报道基于Meynert基底核的深部脑刺激治疗神经退行性疾病认知功能障碍的机制
撰文:刘旭阳,康慧聪
#br#
认知功能障碍是指个体在思维、记忆、注意力、语言和执行功能等方面的能力下降,影响日常生活和社会功能。随着全球老龄化加速,认知功能障碍的发病率逐年上升,成为公共卫生的重要问题。根据世界卫生组织的统计,全球约有5000万名痴呆患者,预计到2050年这一数字将翻倍 [1]。神经退行性疾病,如阿尔茨海默病(Alzheimer’s disease,AD)和路易体痴呆(Lewy body dementia, LBD)是老年人中最为常见的痴呆病因 [2]。迄今为止,尚无有效缓解神经退行性疾病认知障碍的药物治疗。深部脑刺激(deep brain stimulation,DBS)是过去20年临床神经科学中最重要的进展之一。作为一种手术工具,深部脑刺激可直接测量病理性大脑活动,并在与神经环路障碍相关的神经和精神疾病中提供可调节的刺激以达到治疗效果。目前研究者们将深部脑刺激应用于调控认知环路相关疾病中,其中Meynert基底核(nucleus basalis of Meynert, NBM)是深部脑刺激治疗认知功能障碍相关疾病的重要靶点之一。Meynert基底核是大脑中主要的胆碱能神经元来源之一,对认知功能、学习和记忆至关重要,并且在阿尔茨海默病和帕金森病(Parkinson’s disease, PD)等神经退行性疾病中常常受到损害。Meynert基底核-深部脑刺激在痴呆治疗中的探索始于1984年,目前有关Meynert基底核深部脑刺激可应用于各种神经退行性疾病认知障碍的相关临床试验,旨在评价其安全性和有效性,但尚缺乏统一结论,且对Meynert基底核深部脑刺激的治疗机制没有系统的认识和深入的总结。文章汇总了Meynert基底核深部脑刺激在神经退行性病变相关认知障碍的最新研究进展,深入探讨了Meynert基底核深部脑刺激的治疗机制,帮助理解其在神经退行性病变相关认知障碍中的作用提供了参考,指出了现有研究的局限性和挑战,为未来Meynert基底核深部脑刺激研究推动和在临床中进一步应用提供了方向。
中国华中科技大学同济医学院附属同济医院舒凯和康慧聪团队在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Deep
brain stimulation of the nucleus basalis of Meynert in neurodegenerative
diseases with cognitive impairment: An update on evidence and mechanisms”的综述。文章回顾了Meynert基底核深部脑刺激自应用至今的研究进展,主要探讨了其作为一种神经调控手术在治疗阿尔茨海默病和帕金森病等神经退行性疾病中认知功能障碍的潜力、机制及挑战。Meynert基底核深部脑刺激可能通过调节受损的胆碱能系统及神经可塑性、改善葡萄糖代谢、增加区域脑血流、提供神经保护作用或调节异常神经网络来改善认知功能。文章回顾了相关的动物研究和临床证据,强调了Meynert基底核在认知功能中的重要性。表明Meynert基底核深部脑刺激在某些患者中是安全且有效的,但仍需进一步大样本多中心的临床研究以确认其在治疗认知障碍中的有效性。文章建议未来的研究应关注更年轻的患者、个性化的刺激模式以及与药物治疗的结合,以探索多维度的治疗方案。
Meynert基底核是基底前脑(Basal Forebrain, BF)的一个关键组成部分,主要负责向新皮质提供胆碱能输入 [3],并在记忆、皮质觉醒、注意力维持和皮质可塑性调节中起着至关重要的作用 [4-6]。研究表明,Meynert基底核的胆碱能神经元对认知和记忆功能的促进至关重要。此外,Meynert基底核还与多种神经退行性疾病的病理过程有关,特别是阿尔茨海默病和帕金森病痴呆(Parkinson's disease dementia,PDD) [3]。舒凯和康慧聪等首先回顾了早期对Meynert基底核结构和投射区域的研究,介绍了Meynert基底核亚区的主要传出投射和主要传入投射及其对应的相关功能(图1),其中Meynert基底核的传入投射主要局限于边缘系统和副边缘系统区域,大部分来源于杏仁核。传入投射的皮质下边缘结构来源还包括下丘脑、隔核和伏隔核。其余为来自皮质的传入投射,包括梨形皮质、眶前皮质、岛叶、颞极、海马旁回、内嗅皮质和扣带皮质 [7, 8]。在主要的传出投射中,Ch4am为位于半球内侧壁的额叶、顶叶和扣带回皮质提供主要的胆碱能投射,Ch4al组则主要为额顶叶区域和杏仁核提供胆碱能投射。Ch4id和Ch4iv组展现出类似的投射模式,主要向腹外侧眶、岛叶、弓状皮质、周边皮质、颞下回和海马旁回等区域提供胆碱能投射。Ch4p组的传出投射则限于颞上回和颞极 [7-9]。这些投射参与皮质可塑性、新记忆的形成、注意力和记忆巩固等认知相关功能 [10-12]。
Meynert基底核参与认知障碍多种病理生理过程的证据提示以其为靶点的深部脑刺激治疗在改善认知功能障碍中的潜在价值。文章总结了Meynert基底核在两大神经退行性疾病(阿尔茨海默病和帕金森病)病理进展过程中的易损特征。Whitehouse等 [13]首次报道74岁家族性阿尔茨海默病患者的Meynert基底核神经细胞丢失高达90%。随后,越来越多的研究通过结构磁共振成像和尸检揭示了阿尔茨海默病患者Meynert基底核神经细胞的选择性丢失 [14-16],并进一步证实,Meynert基底核功能连通性异常模式与阿尔茨海默病患者的认知受损程度或对胆碱酯酶抑制剂治疗反应之间存在相关性。而在帕金森病患者中Meynert基底核神经细胞损失更为广泛,尤其是在帕金森病相关痴呆患者中更为明显 [17-19]。
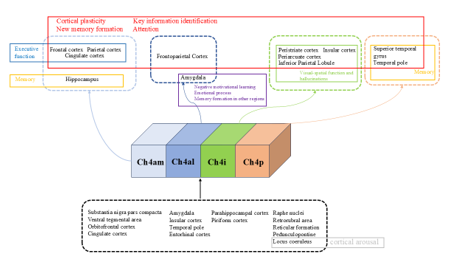
图1 Meynert基底核的主要传入和传出投射及其对应功能
随后,舒凯和康慧聪等总结了目前研究中Meynert基底核深部脑刺激治疗神经退行性疾病相关认知障碍的潜在机制(图2)。首先,Meynert基底核深部脑刺激可能通过调节胆碱能通路来改善注意力和警觉性,从而提高对环境刺激的反应能力来增强神经退行性疾病患者的认知功能。研究表明Meynert基底核深部脑刺激可以增强啮齿类动物中的乙酰胆碱释放,并且这种促进作用与刺激频率相关 [20, 21]。同样在恒河猴中,通过应用胆碱酯酶抑制剂和胆碱受体拮抗剂,发现Meynert基底核深部脑刺激改善工作记忆与乙酰胆碱通路相关 [22]。其次,Meynert基底核-深部脑刺激可能增强脑血流(cerebral blood flow,CBF)和认知相关区域脑葡萄糖代谢速率,以支持其正常功能和代谢活动,从而维持和改善认知。Meynert基底核深部脑刺激治疗阿尔茨海默病的首次尝试证实了在氟脱氧葡萄糖正电子发射计算机断层扫描中,与对侧相比,同侧颞叶和顶叶的葡萄糖代谢活动得到了保存 [23]。随后的多项研究证实了Meynert基底核深部脑刺激对认知相关区域脑葡萄糖代谢速率的影响 [24, 25]。早期的研究利用各种技术观察到,电和化学刺激基底前脑大细胞核增加了啮齿动物皮质的脑血流 [26, 27],进一步研究发现,Meynert基底核深部脑刺激引起的脑血流增加局限于接受来自其胆碱能神经投射的区域,且增加程度与年龄相关 [28, 29]。但目前对于Meynert基底核深部脑刺激是否能够改变疾病背景下的脑血流尚不清楚。
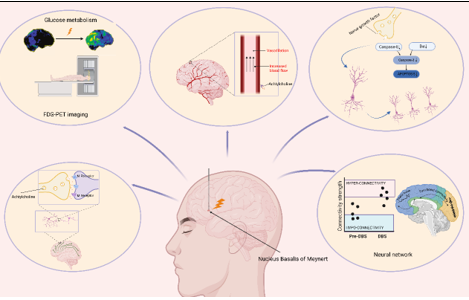
图2 Meynert基底核-深部脑刺激在伴有认知功能障碍的神经退行性疾病中的潜在治疗机制
研究表明,神经生长因子(nerve growth factor,NGF)对神经元的发育至关重要,并以多种方式提供神经保护和神经修复 [30]。文章讨论了Meynert基底核深部脑刺激对神经退行性疾病认知功能障碍的治疗作用还可能与提高神经生长因子水平、激活抗凋亡通路和改善神经元存活等机制相关。Meynert基底核深部脑刺激可提高健康成年大鼠(4-5个月龄)刺激侧皮质的细胞外神经生长因子浓度 [31],而在老年大鼠(29-31个月龄)中未观察到皮质细胞外神经生长因子的显著变化。此外,烟碱受体拮抗剂可以消除这种效应,表明这一功能可能与胆碱能烟碱受体激活有关 [32]。在阿尔茨海默病模型小鼠中,可见Meynert基底核深部脑刺激后小鼠海马和皮质的神经元凋亡减少,且凋亡相关蛋白caspase-3、caspase-8和Bid蛋白表达显著减少,表明Meynert基底核-深部脑刺激可能通过调控抗凋亡相关基因来增加神经元存活从而改善认知功能 [33]。
神经网络在大脑中扮演着至关重要的角色,在认知功能、运动控制和情感调节等方面,通过神经元之间的连接和信号传递来实现信息的处理和存储。Meynert基底核深部脑刺激可能通过调节接收其投射的神经元的放电模式,从而在脑网络水平调控多个脑区的活动,修复神经退行性疾病中受损的神经网络,改善认知功能 [8]。在非人灵长类动物中,研究者观察到15-20 s/min的间歇模式Meynert基底核深部脑刺激显著改善了成年猴在工作记忆任务中的表现,并增加了背外侧前额叶皮质的神经活动,与胆碱能激动剂的效果一致。与胆碱能激动剂不同的是,Meynert基底核深部脑刺激对前额叶皮质内单个神经元的调节更广泛,稳定了维持工作记忆中的信息网络 [34]。在一项为期1年的临床研究中,单纯药物治疗的阿尔茨海默病患者出现theta、alpha和beta波段的脑电波功率下降,而在低频Meynert基底核深部脑刺激患者中得以维持 [24]。在轻度认知障碍的帕金森病患者中,一项脑磁图研究表明,Meynert基底核深部脑刺激开启状态下,患者左额叶、顶叶和颞叶区域的低频活动(delta和/或theta)增加,而右枕叶和小脑区域的高频活动(beta和/或低gamma)增加。与关闭状态相比,Meynert基底核深部脑刺激增加了左半球感兴趣区域(包括左前额叶、顶叶、枕叶和小脑的delta、theta和低gamma波段)以及双侧(包括左、右前额叶皮质的delta波段、左、右感觉运动区的delta、beta和低gamma波段,以及左、右小脑的delta波段)和单侧(包括右侧前额叶、颞叶的theta和alpha波段)区域之间的相干性,从而在一定程度上逆转了帕金森病患者背景活动减慢的振荡特征,并提高了所有频率波段的皮质-皮质相干性,抵消了帕金森病中认知衰退相关的皮质-皮质连接丧失 [35]。后续作者讨论了尽管目前的研究揭示了Meynert基底核深部脑刺激对神经退行性疾病中脑网络的一些影响,但相对于复杂的病理性脑网络,尚需更深入的研究去阐明Meynert基底核深部脑刺激的具体调控机制。
舒凯和康慧聪等进一步总结了目前Meynert基底核深部脑刺激在动物研究和临床研究中的应用进展。动物研究证实了Meynert基底核深部脑刺激在啮齿类动物疾病模型和健康灵长类动物中对空间记忆和工作记忆表现的促进作用。详细讨论了动物研究中不同刺激参数和模式的疗效差异。在这些研究中,刺激的脉宽和电流强度没有显著差异,均在90-100 μs和100-200 μA之间,而不同刺激频率在不同研究中出现了相反的结果,舒凯和康慧聪等表示有必要进一步的实验阐明这些相反结果的产生原因。同时回顾了临床研究中Meynert基底核深部脑刺激的治疗作用,指出Meynert基底核深部脑刺激对认知障碍的治疗效果在阿尔茨海默病患者中更加明显,而在帕金森病痴呆和路易体痴呆患者中仍尚不明确。目前这些研究的一个共同局限性是小样本量降低了结果的可信性,此外,由于刺激参数、模式和持续时间的变化以及疾病的不同阶段可能产生结果差异。因此亟需开展统一刺激参数及模式、更大样本量的多中心临床研究明确Meynert基底核深部脑刺激对神经退行性疾病中认知功能障碍的有效性及安全性。
最后,舒凯和康慧聪等讨论了Meynert基底核深部脑刺激的安全性和未来研究方向。已有的研究表明Meynert基底核深部脑刺激是相对安全的。在动物研究中,Meynert基底核深部脑刺激是比较安全的,但需强调连续刺激可能会带来胆碱能耗竭的潜在风险,在猴子中,80 Hz的连续刺激对工作记忆表现产生了负面影响 [22]。同样在大鼠研究中发现连续刺激后表现出点燃效应 [36]。几项临床研究评估了Meynert基底核深部脑刺激的可行性和安全性 [24, 37-39],结果表明,经过仔细评估入组的有认知障碍和精神症状的神经退行性疾病患者耐受性良好,不会面临严重的不良事件或认知下降风险。
总的来说,目前对Meynert基底核深部脑刺激的探索仍处于早期阶段,需要更多研究来完善治疗策略。首先,考虑到当前研究中显著的个体差异,需要更大规模的多中心研究队列来探讨其有效性及安全性,特别是识别对Meynert基底核深部脑刺激反应更有效的患者群体特征。同时,未来的研究应包括更多早期疾病阶段的年轻患者,因为晚期患者的无效性可能掩盖Meynert基底核深部脑刺激的潜在效果。此外,目前临床应用中使用的刺激模式和方法较局限。开发更优的个性化刺激模式可以帮助提高Meynert基底核深部脑刺激的有效性,例如响应式闭环刺激。未来的研究应集中于探索用于Meynert基底核深部脑刺激治疗认知障碍的生物标志物,开发智能和实时响应的深部脑刺激设备,以适应不同疾病阶段的神经退行性疾病中快速变化的神经网络。更重要的是,将Meynert基底核深部脑刺激与精准的神经系统靶向药物相结合,以探索多维治疗选择,促进认知受损的神经退行性疾病中更全面的神经网络功能恢复。
目前,对于治疗神经退行性疾病中的认知障碍,例如帕金森病痴呆和阿尔茨海默病,尚无预防或逆转病情进展的有效策略来。作为一种针对与认知相关的神经结构和网络的神经调控手术,Meynert基底核深部脑刺激已应用于缓解神经退行性疾病中的认知障碍。临床研究探索了Meynert基底核深部脑刺激改善神经退行性疾病中认知障碍的潜力。同样,在动物研究中,Meynert基底核深部脑刺激已被证明能够改善空间记忆、工作记忆、注意力及其他方面的行为表现。此外,Meynert基底核深部脑刺激治疗伴有认知功能障碍的神经退行性疾病的潜在机制也已经被揭示,包括增强皮质中乙酰胆碱的释放、调节葡萄糖代谢和脑血流、增加皮质中神经生长因子的释放、调控细胞凋亡相关基因表达以提高神经元的存活,以及修复和重构受损的神经网络,但仍需要综合且系统的多模式方法来全面解释Meynert基底核深部脑刺激的机制。同时,亟需开展针对疾病早期阶段患者的大样本多中心临床研究以充分验证其有效性和安全性,并探索个体户响应式闭环刺激参数和模式。本文归纳了Meynert基底核深部脑刺激研究的现有结论和新进展,提供了基础和临床研究的未来方向,推动了Meynert基底核深部脑刺激在神经退行性疾病相关认知功能障碍的临床应用。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00838
参考文献
[1] Scheltens P, De Strooper B, Kivipelto M, et al. Alzheimer's disease. Lancet. 2021;397(10284):1577-1590.
[2] Gale SA, Acar D, Daffner KR. Dementia. Am J Med. 2018;131(10):1161-1169.
[3] Liu AK, Chang RC, Pearce RK, et al. Nucleus basalis of Meynert revisited: anatomy, history and differential involvement in Alzheimer's and Parkinson's disease. Acta Neuropathol. 2015;129(4):527-540.
[4] Kilgard MP, Merzenich MM. Cortical map reorganization enabled by nucleus basalis activity. Science. 1998;279(5357):1714-1718.
[5] Bentley P, Husain M, Dolan RJ. Effects of cholinergic enhancement on visual stimulation, spatial attention, and spatial working memory. Neuron. 2004;41(6):969-982.
[6] Kalmbach A, Hedrick T, Waters J. Selective optogenetic stimulation of cholinergic axons in neocortex. J Neurophysiol. 2012;107(7):2008-2019.
[7] Mesulam MM, Mufson EJ, Levey AI, et al. Cholinergic innervation of cortex by the basal forebrain: cytochemistry and cortical connections of the septal area, diagonal band nuclei, nucleus basalis (substantia innominata), and hypothalamus in the rhesus monkey. J Comp Neurol. 1983;214(2):170-197.
[8] Gratwicke J, Kahan J, Zrinzo L, et al. The nucleus basalis of Meynert: a new target for deep brain stimulation in dementia? Neurosci Biobehav Rev. 2013;37(10 Pt 2):2676-2688.
[9] Mesulam MM, Mufson EJ, Levey AI, et al. Atlas of cholinergic neurons in the forebrain and upper brainstem of the macaque based on monoclonal choline acetyltransferase immunohistochemistry and acetylcholinesterase histochemistry. Neuroscience. 1984;12(3):669-686.
[10] Richardson RT, Delong MR. A reappraisal of the functions of the nucleus basalis of Meynert. Trends Neurosci. 1988;11(6):264-267.
[11] Croxson PL, Kyriazis DA, Baxter MG. Cholinergic modulation of a specific memory function of prefrontal cortex. Nat Neurosci. 2011;14(12):1510-1512.
[12] Mcgaugh JL. Memory consolidation and the amygdala: a systems perspective. Trends Neurosci. 2002;25(9):456.
[13] Whitehouse PJ, Price DL, Clark AW, et al. Alzheimer disease: evidence for selective loss of cholinergic neurons in the nucleus basalis. Ann Neurol. 1981;10(2):122-126.
[14] Teipel SJ, Flatz WH, Heinsen H, et al. Measurement of basal forebrain atrophy in Alzheimer's disease using MRI. Brain. 2005;128(Pt 11):2626-2644.
[15] Teipel SJ, Meindl T, Grinberg L, et al. The cholinergic system in mild cognitive impairment and Alzheimer's disease: an in vivo MRI and DTI study. Hum Brain Mapp. 2011;32(9):1349-1362.
[16] Jethwa KD, Dhillon P, Meng D, et al. Are linear measurements of the nucleus Basalis of Meynert suitable as a diagnostic biomarker in mild cognitive impairment and Alzheimer disease? AJNR Am J Neuroradiol. 2019;40(12):2039-2044.
[17] Sakai K, Ikeda T, Ishida C, et al. Delusions and visual hallucinations in a patient with Parkinson's disease with dementia showing pronounced Lewy body pathology in the nucleus basalis of Meynert. Neuropathology. 2019;39(4):319-323.
[18] Sperling SA, Druzgal J, Blair JC, et al. Cholinergic nucleus 4 grey matter density is associated with apathy in Parkinson's disease. Clin Neuropsychol. 2023;37(3):676-694.
[19] Kübler D, Wellmann SK, Kaminski J, et al. Nucleus basalis of Meynert predicts cognition after deep brain stimulation in Parkinson's disease. Parkinsonism Relat Disord. 2022;94:89-95.
[20] Rasmusson DD, Clow K, Szerb JC. Frequency-dependent increase in cortical acetylcholine release evoked by stimulation of the nucleus basalis magnocellularis in the rat. Brain Res. 1992;594(1):150-154.
[21] Kurosawa M, Sato A, Sato Y. Stimulation of the nucleus basalis of Meynert increases acetylcholine release in the cerebral cortex in rats. Neurosci Lett. 1989;98(1):45-50.
[22] Liu R, Crawford J, Callahan PM, et al. Intermittent stimulation of the nucleus basalis of Meynert improves working memory in adult monkeys. Curr Biol. 2017;27(17):2640-2646.e2644.
[23] Turnbull IM, Mcgeer PL, Beattie L, et al. Stimulation of the basal nucleus of Meynert in senile dementia of Alzheimer's type. A preliminary report. Appl Neurophysiol. 1985;48(1-6):216-221.
[24] Kuhn J, Hardenacke K, Lenartz D, et al. Deep brain stimulation of the nucleus basalis of Meynert in Alzheimer's dementia. Mol Psychiatry. 2015;20(3):353-360.
[25] Jiang Y, Yuan TS, Chen YC, et al. Deep brain stimulation of the nucleus basalis of Meynert modulates hippocampal-frontoparietal networks in patients with advanced Alzheimer's disease. Transl Neurodegener. 2022;11(1):51.
[26] Kurosawa M, Sato A, Sato Y. Well-maintained responses of acetylcholine release and blood flow in the cerebral cortex to focal electrical stimulation of the nucleus basalis of Meynert in aged rats. Neurosci Lett. 1989;100(1-3):198-202.
[27] Biesold D, Inanami O, Sato A, et al. Stimulation of the nucleus basalis of Meynert increases cerebral cortical blood flow in rats. Neurosci Lett. 1989;98(1):39-44.
[28] Adachi T, Biesold D, Inanami O, et al. Stimulation of the nucleus basalis of Meynert and substantia innominata produces widespread increases in cerebral blood flow in the frontal, parietal and occipital cortices. Brain Res. 1990;514(1):163-166.
[29] Adachi T, Inanami O, Ohno K, et al. Responses of regional cerebral blood flow following focal electrical stimulation of the nucleus basalis of Meynert and the medial septum using the [14C]iodoantipyrine method in rats. Neurosci Lett. 1990;112(2):263-268.
[30] Sofroniew MV, Howe CL, Mobley WC. Nerve growth factor signaling, neuroprotection, and neural repair. Annu Rev Neurosci. 2001;24:1217-1281.
[31] Hotta H, Uchida S, Kagitani F. Stimulation of the nucleus basalis of Meynert produces an increase in the extracellular release of nerve growth factor in the rat cerebral cortex. J Physiol Sci. 2007;57(6):383-387.
[32] Hotta H, Kagitani F, Kondo M, et al. Basal forebrain stimulation induces NGF secretion in ipsilateral parietal cortex via nicotinic receptor activation in adult, but not aged rats. Neurosci Res. 2009;63(2):122-128.
[33] Huang C, Chu H, Ma Y, et al. The neuroprotective effect of deep brain stimulation at nucleus basalis of Meynert in transgenic mice with Alzheimer's disease. Brain Stimul. 2019;12(1):161-174.
[34] Qi XL, Liu R, Singh B, et al. Nucleus basalis stimulation enhances working memory by stabilizing stimulus representations in primate prefrontal cortical activity. Cell Rep. 2021;36(5):109469.
[35] Sasikumar S, Cohn M, Harmsen IE, et al. Single-Trajectory Multiple-Target Deep Brain Stimulation for Parkinsonian Mobility and Cognition. Mov Disord. 2022;37(3):635-640.
[36] Koulousakis P, Van Den Hove D, Visser-Vandewalle V, et al. Cognitive improvements after intermittent deep brain stimulation of the nucleus basalis of Meynert in a transgenic rat model for Alzheimer's disease: a preliminary approach. J Alzheimers Dis. 2020;73(2):461-466.
[37] Gratwicke J, Zrinzo L, Kahan J, et al. Bilateral deep brain stimulation of the nucleus basalis of Meynert for Parkinson disease dementia: a randomized clinical trial. JAMA Neurol. 2018;75(2):169-178.
[38] Zhang W, Liu W, Patel B, et al. Case report: Deep brain stimulation of the nucleus basalis of Meynert for advanced Alzheimer's disease. Front Hum Neurosci. 2021;15:645584.
[39] Cappon D, Gratwicke J, Zrinzo L, et al. Deep brain stimulation of the nucleus basalis of Meynert for Parkinson's disease dementia: a 36 months follow up study. Mov Disord Clin Pract. 2022;9(6):765-774.

