NRR: 中国空军军医大学第一附属医院岳康异、罗鹏及蒋晓帆团队总结工程化修饰细胞外囊泡对神经系统疾病的靶向性治疗作用
撰文:杨欣宇
神经系统疾病中,创伤性脑损伤、缺血性脑卒中、帕金森病、阿尔茨海默病、肌萎缩侧索硬化、胶质瘤和精神病,具有高发病率、严重的症状、不理想的预后等特点,给社会造成沉重负担,且目前尚缺乏有效的治疗手段。细胞外囊泡是一种可以包裹生物活性分子的纳米颗粒。细胞外囊泡的膜结构可保护其包裹分子免遭降解并把它们运输到临近或更远的区域[1]。低免疫原性、可修饰性以及血脑屏障透过性[2],可使细胞外囊泡适合用于颅内给药,然而细胞外囊泡的应用依然受限于靶向能力差所带来的安全性问题。
如今对于以上神经系统疾病的治疗依然受限于无法及时发现并处理疾病,在面对复杂病理靶点时无法形成完善的处置策略,疾病的耐药性,大脑靶向药物递送效率低和发病机制不清等问题。除了探索出更多的治疗靶点与新药外,开发一种具有高效脑靶向能力、低毒性、长半衰期并具有多靶点作用能力的药物或生物活性物质运输载体可以加速药物研究的进展。研究证实,通过遗传工程化修饰(genetic engineering)[3]、化学工程化修饰(chemical engineering)[4-6]、物理工程化修饰、代谢标记修饰、亲和性结合以及酶促连接的方式可成功实现对细胞外囊泡表面的靶向性修饰。来自中国空军军医大学第一附属医院岳康异、罗鹏及蒋晓帆团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)上发表题为“Targeting capabilities of engineered extracellular vesicles for the treatment of neurological diseases”的综述文章。文章分别总结了对创伤性脑损伤、缺血性脑卒中、帕金森病、阿尔茨海默病、肌萎缩侧索硬化、胶质瘤和精神病的现有最新治疗进展以及天然细胞外囊泡对上述疾病的治疗进展(图1),回顾了靶向性工程化修饰细胞外囊泡的修饰方法(图2)与其对上述疾病的最新治疗进展,并总结了细胞外囊泡相关的最新临床试验,为神经系统疾病的高效靶向治疗提供新的研究思路。
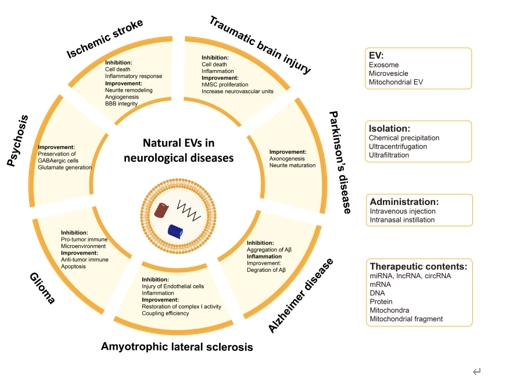
图1 天然细胞外囊泡在神经系统疾病中的应用(图源:Yang et al., Neural Regen Res, 2025)
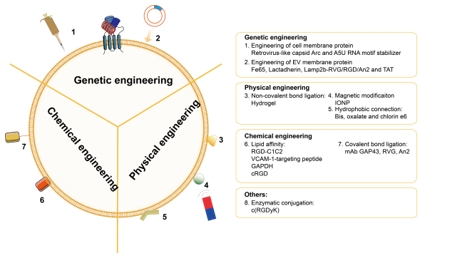
图2 细胞外囊泡的靶向性工程化修饰方法及具体修饰分子(图源:Yang et al., Neural Regen Res, 2025)
遗传修饰可通过病毒转染[7]、质粒转染[8]、或CRISPR/Cas9基因编辑[9]等方式来实现;化学工程化修饰是一种很受欢迎的灵活而又高效的靶向修饰手段,它通过各种交联剂来实现生物分子与细胞外囊泡膜的结合;物理工程化修饰是一批近年用于细胞外囊泡修饰的新方法,它们包括非共价结合、脂质体融合法、磁性修饰和超声修饰等;在代谢标记法修饰中,含亲代细胞的培养基被添加了含叠氮化物的氨基酸[10]或多糖[11]。随后,靶向分子可进一步通过点击化学法修饰其产生的细胞外囊泡[12];亲和性结合利用了特定肽类对细胞外囊泡表面蛋白的亲和力;在酶促连接中,蛋白连接酶可以识别两个肽单元的特定氨基酸序列并介导其连接,此方法在未使用遗传或化学修饰方法的前提下在靶向肽和细胞外囊泡之间建立了共价键连接。综述中,作者归纳和总结了多种靶向物质对细胞外囊泡的靶向靶向性工程化修饰以及其对应的治疗作用(表1)。
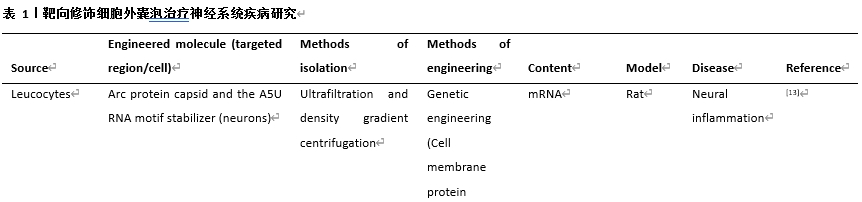
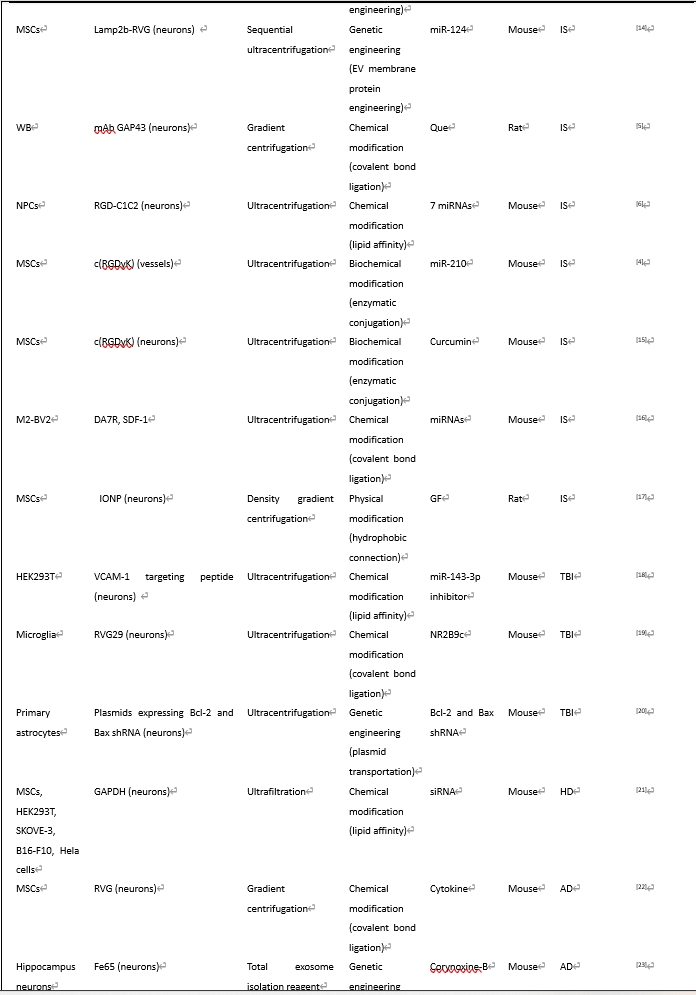
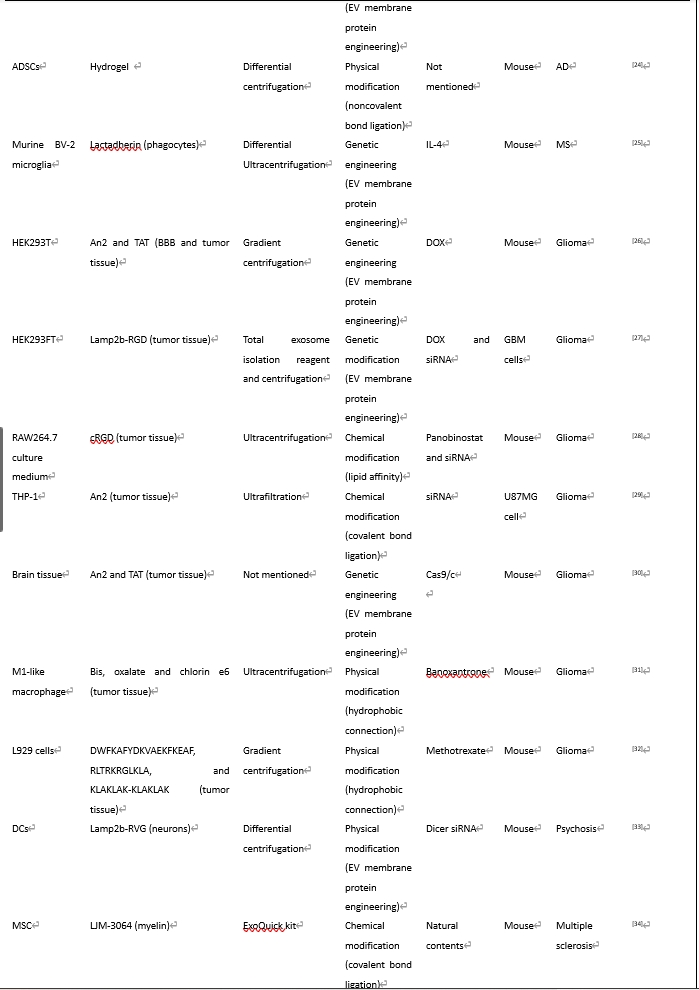
#br#
1.创伤性脑损伤中的工程化细胞外囊泡
Wu等[18]设计了靶向VCAM-1分子的工程化细胞外囊泡,并同时在细胞外囊泡中装载了miR-143-3p抑制剂。随后他们将这些工程化细胞外囊泡用于小鼠创伤性脑损伤模型,结果显示工程化细胞外囊泡可显著降低神经细胞粘附分子(CAM)的表达水平,而CAM会促进中性粒细胞在脑部的浸润。CAM水平的降低促使神经元凋亡减少,并改善了小鼠的运动能力。Haroon等[19]报道了一种名为NR2B9C的神经保护大分子,它可以靶向结合NMDAR和nNOS死亡信号复合体。这种大分子被装载到用狂犬病毒糖蛋白(RVG29)工程化修饰的BV2细胞来源的外泌体中,这些外泌体能够特异性地靶向结合神经元膜上的Ach受体。该研究中使用了DBCO-PEG4-NHS和Azido-RVG29两种修饰介质。最终,注射工程化外泌体显著提高了实验鼠的运动能力,并减少了神经元凋亡。
2.缺血性脑卒中中的工程化细胞外囊泡
一项研究创新性地将包含逆转录病毒样的衣壳Arc蛋白以及A5U蛋白RNA序列稳定器的质粒导入白细胞,以构建工程化的Arc细胞外囊泡,其膜上修饰有转录病毒样的衣壳Arc蛋白和A5U稳定器蛋白。利用Arc蛋白,工程化的Arc细胞外囊泡能促进mRNA的装载,并显著提高神经元对细胞外囊泡的摄取效率[13]。Khan等[14]报告了多种工程化外泌体,例如膜上表达狂犬病毒RVG肽并携带circRNA-SCMHI的外泌体,这类外泌体可运输神经营养因子的mRNA和蛋白质至目标细胞,并抑制脑部炎症;此外,IFN-γ预处理既不影响外泌体的分泌,还能促进外泌体促神经生长和血管生成的作用,抑制凋亡和神经炎症[35]。Yang等[5]则报告了融合蛋白Lamp2b-RVG基因工程化修饰的外泌体能够有效地靶向运输到大脑的缺血区域,并证实了外泌体中的miR-124能够功能性地促进祖细胞转化为神经生长细胞。此外,富含槲皮素的单克隆抗体生长相关蛋白43结合的外泌体(Que/mAb GAP43-exo)能够被靶向运输到缺血半暗带,从而刺激Nrf2/HO-1通路,进一步减少经OGD处理的SH-SY5Y细胞的凋亡水平和ROS水平。在MCAO小鼠模型中,该工程化外泌体能够更加明显降低梗死灶体积。在另一项研究中,来源于神经前体细胞系ReN的细胞外囊泡通过精氨酸-甘氨酸-天冬氨酸-C1C2(RGD-C1C2)进行修饰,RGD-C1C2对整合素受体有亲和力并显示出对缺血脑组织的靶向能力。在MCAO小鼠模型中,静脉注射RGD-C1C2修饰的细胞外囊泡后,细胞外囊泡可通过7种miRNA抑制丝裂原活化蛋白激酶(MAPK)信号通路,表现出抗炎效应[6]。此外,Zhang等[4]构建了环状(Arg-Gly-Asp-D-Tyr-Lys)肽(c(RGDyK))结合的骨髓间充质干细胞来源的细胞外囊泡,其中装载了胆固醇修饰的miR-210。结果表明,c(RGDyk)修饰的细胞外囊泡通过上调整合素β3、VEGF和CD34来促进血管生成,而且其定位效率高于非修饰细胞外囊泡,这通过在病变区域的近红外荧光成像中更高的荧光强度得到了证实。同样,在Tian等[15]的研究中,c(RGDyK)肽通过与DBCO-sulfo-NHS相关的两步反应连接到含有姜黄素的细胞外囊泡上。通过c(RGDyK)肽与整合素αvβ3的相互作用,工程化细胞外囊泡能够将姜黄素递送到病变区域,抑制小胶质细胞的炎性激活,抑制受伤组织的凋亡。此外,一项创新性研究利用磁性纳米颗粒提高了靶向效率。在这个研究中,更多经过磁性工程改造的间充质干细胞来源的细胞外囊泡能够被磁力帽吸引到缺血区域,并发挥治疗作用[17]。
3.神经退行性疾病中的工程化细胞外囊泡
GAPDH通过磷脂酰丝氨酸结合G58结构域与细胞外囊泡结合,促使细胞外囊泡聚集,也增加了细胞外囊泡粒子大小,治疗性siRNA可以装载到细胞外囊泡中,更好地发挥基因沉默作用,进一步用于亨廷顿病的治疗[21]。这为通过细胞外囊泡聚集而非过度修饰来促进向靶向区域传递内容物提供了新的思路。Cui等[22]提出,通过DOPE-NHS连接子将中枢神经系统特异性的RVG肽与间充质干细胞来源细胞外囊泡连接在减轻斑块沉积,Aβ积累,促炎细胞因子释放,降低胶质纤维酸性蛋白水平中显示出更好的效果,进一步改善了学习和记忆能力的缺陷。另一项研究表明,由Fe65工程化修饰的含有柯诺辛B的细胞外囊泡可以靶向APP蛋白并改善阿尔茨海默病小鼠的自噬-溶酶体降解途径[23]。水凝胶能够减缓细胞外囊泡的降解并促进它们的保存。Huang等[23]在间充质干细胞-细胞外囊泡膜上添加了能够分解水凝胶的蛋白酶,从而实现对细胞外囊泡的可控化和智能化释放。通过鼻内给药,阿尔茨海默病小鼠的神经生长得到进一步促进。此外,Casella等[25]用乳脂球蛋白工程化修饰了源自小鼠BV-2小胶质细胞的IL-4+ 细胞外囊泡,以增强对单核细胞和小胶质细胞等吞噬细胞的靶向能力。这样,细胞外囊泡能够更高效地上调多发性硬化症中的抗炎细胞因子CD206、精氨酸酶1和壳多糖酶3样蛋白3,并下调促炎细胞因子IL-17和iNOS。RVG肽和乳脂球蛋白是许多靶向工程过程中的分子,显示了它们帮助细胞外囊泡定位神经退行性疾病的靶区域的卓越性能。
4.胶质瘤中的工程化细胞外囊泡
Liang等[29]发现An2蛋白能促进外泌体靶向到胶质瘤细胞并穿越血脑屏障。他们发现,U87MG细胞摄取的An2修饰的细胞外囊泡数量比未标记的细胞外囊泡增加了约41倍,体现为eoxomes-An2组在大脑中捕获到的更强的荧光。当装载siRNA时,工程化细胞外囊泡对STAT3 通路表现出更强的抑制作用,导致大约94.55%的U87MG细胞在随后发生凋亡。一项研究将HEK293T细胞来源的小型细胞外囊泡用高亲和力的LRP1配体An2和增强穿透血脑屏障能力的转录激活子TAT进行双肽修饰,构建了更高效靶向胶质瘤的sEV。通过装载盐酸多柔比星,工程化细胞外囊泡在体内外均显示了更好的抗肿瘤效果[26]。另一项研究也将细胞外囊泡进行了An2和TAT修饰,来增强细胞外囊泡穿过细胞膜的能力,由此构建了含有Cas9/sgGSS复合物的双修饰细胞外囊泡。结果显示,An2/TAT-sgGSS-细胞外囊泡可以诱导铁死亡并通过耗竭GSS提高放射敏感性[30]。尽管双肽修饰是一种强化靶向能力的想法,但必须承认,由此导致的工作量提升和潜在的成本负担的加大仍然值得担忧。Gečys等[27]将多柔比星和表观遗传调节剂siRNA装载在细胞外囊泡中,并用Lamp2b-RGD融合蛋白进行工程化修饰。定量分析显示,与非修饰细胞外囊泡相比,RGD-细胞外囊泡被胶质母细胞瘤吸收的数量可增加约40%。同时,研究还表明,装载siRNA的RGD-细胞外囊泡在GAPDH敲除方面具有更高的效率。此外,一项研究构建了cRGD修饰的巨噬细胞来源的细胞外囊泡,其中装载了帕比司他和与微胶粒预连接的siRNAs,以通过血脑屏障将药物靶向运输到胶质母细胞瘤。具体的说,首先将帕比司他装载到带正电荷的微胶粒中,通过静电吸附将PPM1D siRNA包覆在DEP的表面,生成DEP-siRNA。然后,通过点击化学法将肿瘤靶向肽cRGD与RAW264.7巨噬细胞来源的细胞外囊泡连接。最后,细胞外囊泡膜通过共排出过程被提取并包裹DEP-siRNA,生成cEM@DEP-siRNA。这种工程化策略提高了帕比司他(其水溶性差且BBB穿透效率低)的大脑靶向递送效率[28]。关于靶向运输至免疫微环境,来自M1样巨噬细胞的细胞外囊泡被证明可以通过诱导M2至M1表型的转换来调节胶质母细胞瘤的免疫微环境,并增加了ROS的生成。Wang等[31]首先将M1样巨噬细胞与失活的化疗药物AQ4N共培养,以获取携带AQ4N的细胞外囊泡(A-M1EVs)。接着,他们通过将疏水性的2,4,5-三氯-6-羧丙基苯酚,草酸盐(CPPO,C)和氯吲哚6(Ce6,C)连接到细胞外囊泡,将A-M1EVs工程化修饰化为CCA-M1EVs,以进一步增加活性氧物质的生成。最后,CCA-E1EVs显示出更强的抗肿瘤效应,表现为8小时后渗透效率达到30%。在另一份报告中,Ye等[32]构建了功能化的含甲氨蝶呤的细胞外囊泡,其连接了ApoA-I模拟肽4F(DWFKAFYDKVAEKFKEAF),ApoB LDL受体结合域(RLTRKRGLKLA)以及治疗性的KLA(KLAKLAK-KLAKLAK)。他们证明,U87细胞摄取的EVs-LDL和EVs-KLA-LDL的数量显著高于非修饰细胞外囊泡。这表明这些功能化细胞外囊泡能够有效提高药物递送效率。
5.精神病中的工程化细胞外囊泡
关于精神病中工程化细胞外囊泡的研究非常有限。其中一项研究报告了载有miR-124的树突状细胞来源的工程化细胞外囊泡,它可以下调TLR4、MYD88和STAT3,从而减轻在可卡因使用障碍的大脑中可见的可卡因介导的小胶质细胞(Iba1)活化,此过程通过将小鼠树突状细胞与Dicer siRNA和Lamp2b-RVG质粒共转染,分别耗尽内源性miRNAs与靶向中枢神经系统[33]。尽管目前由于复杂的病理机制限制了精神疾病治疗的发展,但考虑到其在其他神经疾病中展现出的巨大潜力,工程化细胞外囊泡的治疗应用仍然值得期待。
综上所述,文章主要关注在一些代表性神经系统疾病(如创伤性脑损伤、缺血性中风、帕金森病、阿尔茨海默病、肌萎缩性侧索硬化、胶质瘤和精神病)中,经过工程改造的外泌体(细胞外囊泡)在靶向药物传递中的研究进展。与传统药物传递系统相比,源自母细胞的细胞外囊泡在保护药物成分免受降解和穿透血脑屏障方面具有显著优势外。此,在一定程度上,它们能够针对其母细胞所在的区域进行靶向。然而,由于细胞外囊泡强大的吞噬能力,仍然有大量的细胞外囊泡可以在某些器官,包括肝脏、肺和脾脏中积累。为增强细胞外囊泡的靶向能力,研究人员已经开发了多种物理(超声、磁性)、化学(DSPE-NHS、NHS-DSPE等)和遗传修饰(与Lamp2b、CD9、CD63、CD81等融合的肽/蛋白质)方法。多种材料和分子,包括Fe3O4、肽(RVG、An2、RGD等)、单克隆抗体(抗生长相关蛋白43等)和DNA适配体(AS1411、LJM-3064等),被用于靶向工程)。结果显示,这些策略显著提高了神经细胞的靶向能力。值得注意的是,近期的研究倾向于同时采用多种策略和分子进行细胞外囊泡的靶向修饰,以提高其特异性、亲和力和生物稳定性。此外,研究者仍在不断开发新的靶向分子进一步优化中枢神经系统靶向细胞外囊泡的应用。与此同时,不可忽视的是,由于安全性、改造效率低、成本高和改造复杂性等原因,靶向性工程化修饰的细胞外囊泡的临床转化仍然存在许多问题。其中,安全性问题包括工程化修饰引起的免疫原性和细胞毒性问题,以及工程改造的细胞外囊泡积累或工程分子与神经细胞相互作用引起的副作用,应该被严肃考虑。细胞外囊泡的安全使用浓度和副作用应该在细胞、动物和人体中进行全面评估。此外,应当开发更多的靶向策略和修饰物,进一步改善细胞外囊泡对中枢神经系统神经细胞的特异识别。然而不可否认的是,靶向性工程化修饰的细胞外囊泡在治疗神经系统疾病方面仍然具有巨大的潜力。因此,必须进行进一步的研究,推动工程化细胞外囊泡的发展。通过这些努力,我们有望将靶向修饰细胞外囊泡的治疗性应用转化为临床实践,为神经系统疾病患者带来更有效、更安全的治疗选择。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00462
参考文献
[1] Van Niel G, Carter DRF, Clayton A, et al. Challenges and directions in studying cell-cell communication by extracellular vesicles. Nat Rev Mol Cell Biol. 2022;23(5):369-382.
[2] Meng W, He C, Hao Y, et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 2020;27(1):585-598.
[3] Khan FA, Pandupuspitasari NS, Chun-Jie H, et al. CRISPR/Cas9 therapeutics: a cure for cancer and other genetic diseases. Oncotarget. 2016;7(32):52541-52552.
[4] Zhang H, Wu J, Wu J, et al. Exosome-mediated targeted delivery of miR-210 for angiogenic therapy after cerebral ischemia in mice. J Nanobiotechnology. 2019;17(1):29.
[5] Guo L, Huang Z, Huang L, et al. Surface-modified engineered exosomes attenuated cerebral ischemia/reperfusion injury by targeting the delivery of quercetin towards impaired neurons. J Nanobiotechnology. 2021;19(1):141.
[6] Tian T, Cao L, He C, et al. Targeted delivery of neural progenitor cell-derived extracellular vesicles for anti-inflammation after cerebral ischemia. Theranostics. 2021;11(13):6507-6521.
[7] Wang H, Wang B, Zhang A, et al. Exosome-mediated miR-29 transfer reduces muscle atrophy and kidney fibrosis in mice. Mol Ther. 2019;27(3):571-583.
[8] Du J, Wan Z, Wang C, et al. Designer exosomes for targeted and efficient ferroptosis induction in cancer via chemo-photodynamic therapy. Theranostics. 2021;11(17):8185-8196.
[9] Hazrati A, Malekpour K, Soudi S, et al. CRISPR/Cas9-engineered mesenchymal stromal/stem cells and their extracellular vesicles: A new approach to overcoming cell therapy limitations. Biomed Pharmacother. 2022;156:113943.
[10] Qian R, Jing B, Jiang D, et al. Multi-antitumor therapy and synchronous imaging monitoring based on exosome. Eur J Nucl Med Mol Imaging. 2022;49(8):2668-2681.
[11] Lim GT, You DG, Han HS, et al. Bioorthogonally surface-edited extracellular vesicles based on metabolic glycoengineering for CD44-mediated targeting of inflammatory diseases. J Extracell Vesicles. 2021;10(5):e12077.
[12] Deng M, Guo R, Wang Y, et al. Curbing exosome communications via introducing artificial membrane receptors for metastatic pancreatic cancer therapy. Adv Mater. 2023;35(39):e2303736.
[13] Gu W, Luozhong S, Cai S, et al. Extracellular vesicles incorporating retrovirus-like capsids for the enhanced packaging and systemic delivery of mRNA into neurons. Nat Biomed Eng. 2024;8(4):415-426.
[14] Yang J, Zhang X, Chen X, et al. Exosome mediated delivery of miR-124 promotes neurogenesis after ischemia. Mol Ther Nucleic Acids. 2017;7:278-287.
[15] Tian T, Zhang HX, He CP, et al. Surface functionalized exosomes as targeted drug delivery vehicles for cerebral ischemia therapy. Biomaterials. 2018;150:137-149.
[16] Ruan H, Li Y, Wang C, et al. Click chemistry extracellular vesicle/peptide/chemokine nanocarriers for treating central nervous system injuries. Acta Pharm Sin B. 2023;13(5):2202-2218.
[17] Kim HY, Kim TJ, Kang L, et al. Mesenchymal stem cell-derived magnetic extracellular nanovesicles for targeting and treatment of ischemic stroke. Biomaterials. 2020;243:119942.
[18] Wu X, Liu H, Hu Q, et al. Astrocyte-derived extracellular vesicular miR-143-3p dampens autophagic degradation of endothelial adhesion molecules and promotes neutrophil transendothelial migration after acute brain injury. Adv Sci (Weinh). 2024;11(5):e2305339.
[19] Haroon K, Zheng H, Wu S, et al. Engineered exosomes mediated targeted delivery of neuroprotective peptide NR2B9c for the treatment of traumatic brain injury. Int J Pharm. 2024;649:123656.
[20] Wang B, Han S. Modified exosomes reduce apoptosis and ameliorate neural deficits induced by traumatic brain injury. ASAIO J. 2019;65(3):285-292.
[21] Dar GH, Mendes CC, Kuan WL, et al. GAPDH controls extracellular vesicle biogenesis and enhances the therapeutic potential of EV mediated siRNA delivery to the brain. Nat Commun. 2021;12(1):6666.
[22] Cui GH, Guo HD, Li H, et al. RVG-modified exosomes derived from mesenchymal stem cells rescue memory deficits by regulating inflammatory responses in a mouse model of Alzheimer's disease. Immun Ageing. 2019;16:10.
[23] Iyaswamy A, Thakur A, Guan XJ, et al. Fe65-engineered neuronal exosomes encapsulating corynoxine-B ameliorate cognition and pathology of Alzheimer's disease. Signal Transduct Target Ther. 2023;8(1):404.
[24] Huang M, Zheng M, Song Q, et al. Comparative Proteomics Inspired Self-Stimulated Release Hydrogel Reinforces the Therapeutic Effects of MSC-EVs on Alzheimer's Disease. Adv Mater. 2024;36(14):e2311420.
[25] Casella G, Colombo F, Finardi A, et al. Extracellular vesicles containing IL-4 modulate neuroinflammation in a mouse model of multiple sclerosis. Mol Ther. 2018;26(9):2107-2118.
[26] Zhu Z, Zhai Y, Hao Y, et al. Specific anti-glioma targeted-delivery strategy of engineered small extracellular vesicles dual-functionalised by Angiopep-2 and TAT peptides. J Extracell Vesicles. 2022;11(8):e12255.
[27] Gečys D, Kazlauskas A, Gečytė E, et al. Internalisation of RGD-engineered extracellular vesicles by glioblastoma cells. Biology (Basel). 2022;11(10):1483.
[28] Shan S, Chen J, Sun Y, et al. Functionalized macrophage exosomes with panobinostat and PPM1D-siRNA for diffuse intrinsic pontine gliomas therapy. Adv Sci (Weinh). 2022;9(21):e2200353.
[29] Liang SF, Zuo FF, Yin BC, et al. Delivery of siRNA based on engineered exosomes for glioblastoma therapy by targeting STAT3. Biomater Sci. 2022;10(6):1582-1590.
[30] Liu X, Cao Z, Wang W, et al. Engineered extracellular vesicle-delivered CRISPR/Cas9 for radiotherapy sensitization of glioblastoma. ACS Nano. 2023;17(17):16432-16447.
[31] Wang X, Ding H, Li Z, et al. Exploration and functionalization of M1-macrophage extracellular vesicles for effective accumulation in glioblastoma and strong synergistic therapeutic effects. Signal Transduct Target Ther. 2022;7(1):74.
[32] Ye Z, Zhang T, He W, et al. Methotrexate-loaded extracellular vesicles functionalized with therapeutic and targeted peptides for the treatment of glioblastoma multiforme. ACS Appl Mater Interfaces. 2018;10(15):12341-12350.
[33] Chivero ET, Liao K, Niu F, et al. Engineered extracellular vesicles loaded with miR-124 attenuate cocaine-mediated activation of microglia. Front Cell Dev Biol. 2020;8:573.
[34] Hosseini Shamili F, Alibolandi M, Rafatpanah H, et al. Immunomodulatory properties of MSC-derived exosomes armed with high affinity aptamer toward mylein as a platform for reducing multiple sclerosis clinical score. J Control Release. 2019;299:149-164.
[35] Khan H, Pan JJ, Li Y, et al. Native and bioengineered exosomes for ischemic stroke therapy. Front Cell Dev Biol. 2021;9:619565.




