NRR:中国广东省人民医院李戈团队联合澳门大学王芷廷团队总结自噬在脊髓损伤治疗中的双重作用:调控策略为神经修复提供新方向
撰文:王睿
脊髓损伤(Spinal Cord Injury)是一种严重的神经系统疾病,可由创伤性或非创伤性因素引起。脊髓损伤常导致严重后果,如感觉、运动功能障碍,甚至瘫痪和内脏功能丧失。目前,脊髓损伤的治疗方式多以缓解症状、解除脊髓压迫和消除炎症为主 [1],仍旧缺乏修复神经组织,恢复神经元功能的手段。
自噬(Autophagy)是细胞通过溶酶体降解受损或多余细胞成分,维持稳态的重要生理过程。自1950年代发现自噬开始,它的过程及其在疾病中的重要作用被不断发掘;研究表明,自噬可以作为一些疾病治疗的重要靶点 [2]。而在脊髓损伤中,诱导及过度诱导自噬都十分重要,所以,靶向自噬为脊髓损伤的治疗带来了新的可能。自噬既对脊髓损伤治疗产生积极的影响,但过度自噬又损伤神经。因此如何精准调节自噬水平和选择性,以达到既促进神经保护又避免过度激活的平衡,并通过何种方法作为潜在策略介入脊髓损伤治疗,都需要进一步探讨。
中国广东省人民医院李戈团队以及澳门大学王芷廷团队,在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“The role of autophagy
in spinal cord injury: Mechanisms, crosstalk, and therapeutic strategies”的最新综述。文章首先回顾了自噬的发现与研究进展,接着介绍了自噬的分类、激活机制、形成过程及调控途径。随后探讨了脊髓损伤的机制及多种神经细胞在自噬过程中的作用,分析了脊髓损伤中自噬水平的变化及自噬在外伤性脊髓损伤中的表现,讨论了脊髓损伤过程中自噬与细胞凋亡、铁死亡等多种细胞死亡方式的交互作用。最后总结了自噬在改善脊髓损伤中的潜力,并展望了其在临床转化中的前景。
自噬是细胞通过溶酶体降解细胞内损伤或过剩的生物分子,以维持细胞稳态的生理过程。自噬的研究经历了多个阶段:1955年,比利时生物化学家Christian de Duve发现了溶酶体并创造了“自噬”一词,用来描述细胞降解和回收其成分的过程,特别是在对压力或营养剥夺的反应中;1974年,研究人员使用电子显微镜观察了细胞中的自噬空泡,这些空泡被鉴定为参与细胞质组分降解的双膜结构。在20世纪70-80年代,认为自噬可以作为细胞在营养剥夺条件下生存的一种方式的观点开始出现。研究人员还假设,自噬可能参与细胞内稳态,维持细胞中的细胞器和蛋白质的平衡。2000-2005年期间,研究开始关注自噬在各种疾病中的作用,在神经退行性疾病中,研究表明帕金森病、阿尔茨海默病和亨廷顿病等疾病与自噬途径的缺陷有关。2005年,丹尼尔·克里恩斯基创办了第一本自噬杂志《Autophagy》,并发表了一系列关于自噬机制的研究论文。2016年,小津吉森因其在自噬分子机制方面的开创性工作而获得诺贝尔生理学或医学奖(图1)。

图1 自噬的理论发展和里程碑
自噬根据底物运输至溶酶体的方式可分为巨自噬、微自噬和伴侣介导自噬(图2)。巨自噬通过双膜小泡包裹底物,与溶酶体融合后降解(图3),巨自噬几乎发生在所有真核细胞中,通常在各种生理刺激引起的细胞应激反应中上调;微自噬则通过溶酶体直接吞噬细胞成分,微自噬比巨自噬更具选择性,可由受损细胞器表面的信号分子触发;伴侣介导自噬则通过分子伴侣识别特定底物,将其带入溶酶体降解。巨自噬还可分为选择性和非选择性自噬,前者选择性地降解特定的细胞成分。
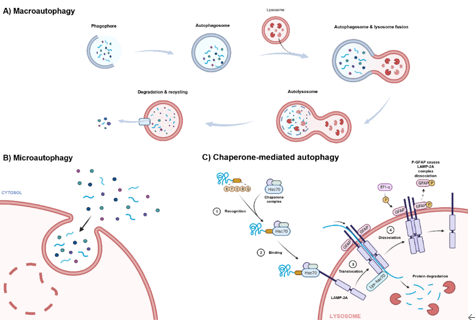
图2 三种自噬:(A)巨自噬(B)微自噬(C)分子伴侣介导的自噬
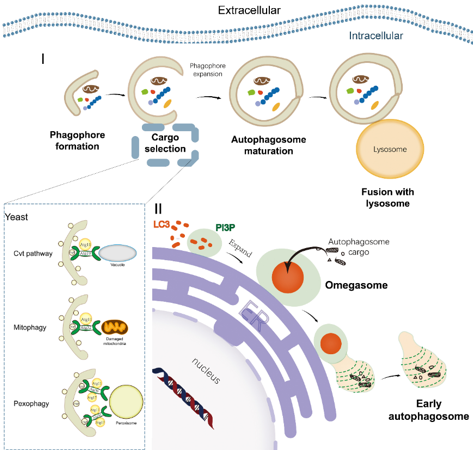
图3 巨自噬中2种自噬体形成机制和3种选择性自噬机制
自噬在维持细胞稳态和应对压力反应中起着重要作用,参与肝脏代谢、清除损伤细胞器,防止其积累并避免毒性效应。自噬功能紊乱与神经退行性疾病如帕金森病和阿尔茨海默病相关,增强自噬有助于减缓疾病进展。自噬的启动由内外应激信号如饥饿、缺氧、能量消耗引发,主要由mTOR和PI3K通路调控。mTOR在营养充足时抑制自噬,而在缺乏营养时被抑制,激活自噬。PI3K通路通过生成PIP3激活Akt信号通路,调节自噬的平衡。自噬体的形成需要多个蛋白复合物的协同作用,ULK1复合物激活启动自噬,PI3K复合物通过生成PI3P促进自噬蛋白招募。
脊髓损伤是由创伤或其他因素引起的神经病理状态,常导致运动和感觉丧失,严重时可引发瘫痪和内脏功能障碍。随着医学进展,脊髓损伤患者的生存率逐渐提高,但神经修复仍面临巨大挑战。根据脊髓损伤的发生发展,其病理生理机制也可分为原发性损伤和继发性损伤。原发性损伤由脊柱骨折或外力破坏脊髓结构引起,伴随轴突和血管损伤。继发性损伤则由炎症反应、氧化应激、细胞死亡等因素引起,导致神经毒性、钙离子过载、离子平衡失调及白质退化。炎症反应中的巨噬细胞激活及兴奋性毒性是脊髓损伤进展的重要机制(图4)。自噬对脊髓损伤至关重要。尽管神经元在正常生理条件下自噬活性较低,但脊髓损伤后,自噬成为重要的代谢降解途径。在脊髓损伤早期,神经元自噬活性上调,损伤区域的反应性胶质细胞中自噬尤为显著。星形胶质细胞在缺血或低氧环境下会显著增加自噬,尽管这可能加剧细胞损伤。少突胶质细胞和小胶质细胞的自噬也参与脊髓损伤修复,小胶质细胞通过调节炎症反应发挥重要作用。脊髓损伤后的自噬反应可分为过度激活与自噬抑制。研究发现,过度自噬可能导致细胞死亡,加剧神经功能丧失。自噬异常与脊髓损伤相关的病理变化密切相关,包括胶质瘢痕形成、髓鞘脱失与再髓鞘化、以及炎症反应的增强。自噬通量的变化在脊髓损伤不同阶段具有重要意义,通过LC3、Beclin-1、p62等标记物的检测,可以揭示细胞自噬水平的变化(图3)。
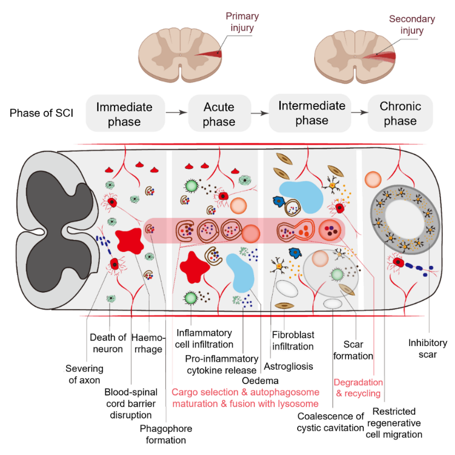
图4 继发性脊髓损伤的病理生理过程
DNA甲基化、组蛋白甲基化和后转录修饰对自噬的调节发挥重要作用。DNA甲基化改变显著影响自噬相关基因的表达,如ATG16L,LC3等,抑制自噬活性,导致神经元死亡。EHMT2(G9a)过表达抑制神经元自噬,促进炎症反应和胶质瘢痕形成,阻碍轴突再生。CARM1通过去甲基化作用促进自噬相关基因转录激活,脊髓损伤中CARM1的上调通过AMPK-SKP2-CARM1信号通路增强自噬,改善神经功能。此外,后转录修饰如ULK1磷酸化和HDAC6去乙酰化等也会影响自噬活性。因此,调节这些分子通路可能成为脊髓损伤治疗的新策略。
自噬和凋亡是调节细胞命运的两个基本机制,它们之间有着复杂的联系。它们的调节由许多共同的信号因子控制,例如p53蛋白、丝氨酸/苏氨酸激酶、BH3仅蛋白和原癌基因,这些因子影响着自噬和凋亡。在脊髓损伤的背景下,这些过程之间的相互作用对于决定神经元的生存或死亡至关重要。凋亡通过线粒体功能障碍和死亡受体激活途径,导致神经元损伤,自噬的调节能缓解或加剧这种损伤。自噬通过PINK1与Beclin-1合作,发挥神经保护作用,但自噬失调则加剧凋亡(图5)。铁死亡则是由铁引发的活性氧积累与脂质过氧化作用所致,其在脊髓损伤中的发生与铁超载密切相关。自噬通过铁蛋白降解(NCOA4介导的铁死亡)与脂质自噬(RAB7A介导的自噬)在脊髓损伤中调节铁死亡过程。自噬与铁死亡之间的相互作用通过Beclin-1、HMGB1等分子实现,二者共同促进了细胞的氧化损伤和神经元死亡。调节自噬的活性,特别是与铁死亡相互作用的路径,可能成为脊髓损伤治疗的新策略,以减轻继发性损伤、促进神经保护和功能恢复。
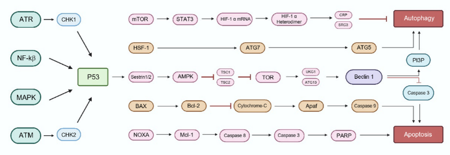
图5 自噬与凋亡的交叉通路
另外,在脊髓损伤中,细胞死亡模式如焦亡、依赖性细胞死亡(Parthanatos)和线粒体自噬(Mitophagy)与自噬密切相关。焦亡通过线粒体活性氧激活NLRP3炎症小体,加剧神经炎症和细胞损伤。Parthanatos则通过PARP-1的过度激活导致线粒体功能障碍和DNA断裂,进一步加重二次损伤。线粒体自噬选择性清除受损线粒体,减少活性氧积累,保护神经细胞存活。研究表明,调控这些死亡通路与自噬的交互作用,如通过SIRT3,Nrf2等通路,可能为脊髓损伤的治疗提供新的策略。
研究表明,在脊髓损伤中,适当诱导自噬可以清除受损的细胞器和细胞,延缓细胞死亡与凋亡的发生,促进损伤修复,并维持和恢复神经功能。急性脊髓损伤引发的炎症反应中,星形胶质细胞调节线粒体功能与自噬相关。自噬通过去除受损线粒体,维持线粒体网络功能。在Atg7基因敲除小鼠模型中,星形胶质细胞形成过度融合的线粒体群体,并发生大量凋亡。在灰质中,自噬体主要积聚在神经元中,运动神经元的功能依赖于自噬流。mTOR负向调节自噬,减少p70S6K的磷酸化并升高Beclin-1和LC-3的水平,从而减少脊髓区域的神经元死亡。在一些动物模型中,自噬诱导剂和抑制剂均表现出一定的治疗效果。自噬的激活可促进神经元存活、轴突生成,减少炎症反应,提高运动功能。总的来说,自噬的激活在脊髓损伤中的主要作用是防止进一步损伤,保护神经组织功能,并协助修复。
脊髓损伤的治疗目前仍存在较大挑战,现有的治疗方法,包括药物治疗、手术治疗和细胞疗法,通常只能维持伤情稳定,尚无法有效修复受损组织并恢复神经功能。因此需要开发新的治疗策略。自噬被认为是脊髓损伤中的一种保护机制,能够通过维持细胞生存、降解受损的细胞成分和延缓凋亡的发生,减轻二次损伤。因此,诱导自噬的激活或抑制过度自噬,可能成为治疗脊髓损伤的关键策略。现有研究已证实,药物干预自噬不仅能控制脊髓损伤的进展,还可能促进损伤修复。
在增强自噬的药物方面,二甲双胍被发现能够激活自噬,减少组织损伤和神经元死亡,并改善神经功能恢复。成纤维生长因子1、神经干细胞外泌体、黄芪皂苷IV等也能通过激活自噬改善脊髓损伤后的恢复。相反,一些抑制自噬的药物,如双过氧钒、3-甲基腺嘌呤等,则通过抑制自噬减少神经元死亡,并在实验模型中改善运动功能和组织恢复。
总之,自噬在脊髓损伤中的作用复杂,既可能是保护性的,也可能是有害的。因此,如何在伤后调节自噬的水平,维持自噬的平衡,将是未来治疗脊髓损伤的重要策略。通过精准调控自噬的分子机制,可能为脊髓损伤治疗带来新的突破。
自噬在创伤性脊髓损伤中发挥着至关重要的作用,自噬的启动或抑制是脊髓损伤反应的一个关键机制。然而,自噬是保护性的还是破坏性的,仍需根据损伤的程度和持续时间进行具体分析。自噬的激活和抑制都可以用于治疗创伤性脊髓损伤,因此在伤后控制自噬水平的平衡可能是合理使用自噬激活剂和抑制剂的一个重要策略。我们认为,通过调节凋亡间接调控自噬可能是一个潜在的治疗策略。同时,还需要进一步研究自噬在脊髓损伤不同阶段的分子机制,实现对自噬的严格调控,以更精准、更有效的方式治疗脊髓损伤。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-01467
参考文献
[1] Fehlings MG, Pedro K, Hejrati N. Management of Acute Spinal Cord Injury: Where Have We Been? Where Are We Now? Where Are We Going? J Neurotrauma. 2022;39(23-24):1591-1602.
[2] Mizushima N, Levine B. Autophagy in Human Diseases. N Engl J Med. 2020;383(16):1564-1576.




