NRR:南通大学赵莉莉和顾晓松团队揭示背根神经节神经元在神经损伤后的3个反应阶段
撰写:赵莉莉,张涛,黄未校,顾晓松
相对于中枢神经系统在受损后极难恢复,周围神经系统仍存在一定的再生能力,然而这种能力并不足以满足临床神经损伤修复及运动和感觉功能恢复的需求[1]。坐骨神经是支配下肢感觉和运动的主要神经,其感觉神经元胞体位于椎间隙的背根神经节内。研究坐骨神经损伤后背根神经节神经元的分子变化及调控网络有利于认识神经系统的再生能力。借助于单细胞测序技术[2],可明确背根神经节中的细胞种类及神经元的亚类。在神经损伤后,不同神经元亚类的反应存在着一定的差异,也有很多的共性[3, 4]。由于高通量的测序技术具有一定的限制,如投入的细胞数量及大小、测序的深度、细胞分离方法等都会影响最终的测序结果[5]。因此,对于背根神经节神经元轴突再生过程中详尽的分子表达谱的研究仍有欠缺。
近期,来自中国南通大学顾晓松团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)上发表了题为“Transcriptional regulatory network during axonal regeneration of dorsal root ganglion neurons: laser-capture microdissection and deep sequencing”的研究于联合激光显微切割和深度测序后,发现坐骨神经损伤后,背根神经节神经元的反应呈现3个阶段:早期阶段、预再生阶段和再生阶段。受到早期信号的调节,以Atf3为核心的包括Crem,Arid5a,Fosl1和Klf6的再生相关转录因子网络被激活,继而启动大量的再生相关基因表达,从而实现轴突再生。该研究提供了背根神经节神经元轴突再生过程中详尽的分子表达谱,为临床上筛选分子靶点提供了参考。
为获得背根神经节神经元轴突再生的分子表达谱,顾晓松等通过联合激光显微切割和深度测序对坐骨神经夹伤后的不同时间点的背根神经节神经元进行深度测序(图1)。
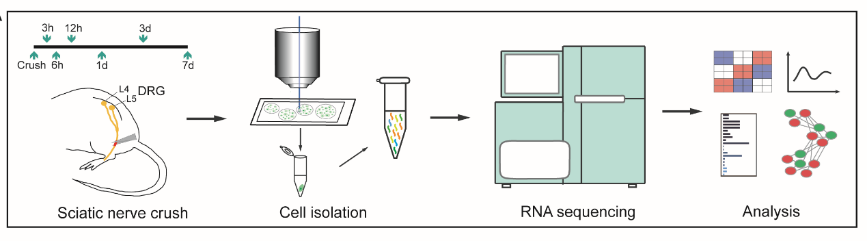
图1:联合激光显微切割和深度测序的技术路线(图源:Zhao et al., Neural Regen Res, 2023)
基于细胞的分子表达差异,背根神经节神经元在损伤后呈现了3个阶段:早期阶段(3-12h),预再生阶段(1d)以及再生阶段(3-7d)。结合权重共表达网络分析,早期阶段(对应Magenta和Greenyellow模块)主要涉及突触的组织受体活化等方面,预再生阶段(对应Pink模块)主要涉及信号传递及转录调控等方面,再生阶段(对应Pink和Blank模块)主要涉及神经发生和免疫及炎症等方面(图2)。
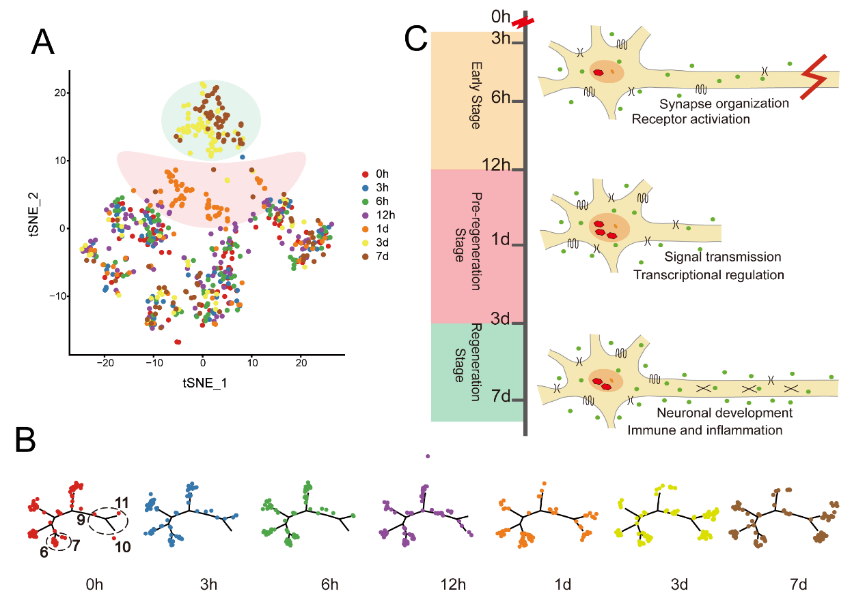
图2:背根神经节神经元受损后呈现出3个不同阶段(图源:Zhao et al., Neural Regen Res, 2023)
在预再生阶段,Atf3,Jun,Smad1,Myc,Nfil3等大量的再生相关转录因子被激活[6]。通过分子互作分析,这些转录因子构成了以Aft3为核心的转录因子网络。在该网络中,除刚提到的再生相关转录因子外,还有许多转录因子在周围神经系统中未被报道过。其中Crem,Fosl1和Klf6曾被发现在损伤后的视网膜神经节细胞中表达上调[7-9],但它们在背根神经节神经元轴突再生过程中的表达及功能仍然未知。Arid5a的研究主要在免疫相关方面[10],其在神经系统中的研究仍是空白。测序结果显示轴突受损后,Crem,Arid5a,Fosl1和Klf6 RNA水平显著上调。顾晓松等进一步以免疫荧光染色发现其在受损后的背根神经节神经元中蛋白水平也明显上升。接着又通过小RNA片段在原代培养的背根神经节神经元中分别敲降这4种转录因子,结果显示,神经元的突起生长受到明显抑制(图3)。

图3:Crem,Arid5a,Fosl1和Klf6在背根神经节神经元轴突再生过程中表达上调且对轴突生长是必要的(图源:Zhao et al., Neural Regen Res, 2023)
作为再生相关转录因子网络的核心,Atf3的表达和转录调控活性从损伤后的12h起显著升高,且其靶基因也在损伤后3d时起呈现上升趋势,且能够参与信号传递、细胞发育、骨架重塑、免疫炎症等多个方面的调控。虽然Atf3的功能在此之前被报道过[3, 11],但其上游调控因子仍不是十分清楚。顾晓松等预测发现,Gper1,Il12a,ESR1和IL6 可能会是早期阶段轴突损伤修复过程中触发Atf3的激活的上游因子(图4)。
图4:Atf3在背根神经节神经元轴突再生过程中的表达及调控网络(图源:Zhao et al., Neural Regen Res, 2023)
该研究通过深度测序揭示了背根神经节神经元轴突再生过程中的分子表达谱,发现了背根神经节神经元在受损后呈现了3个不同的阶段,分别是早期阶段、预再生阶段以及再生阶段。通过分析预再生阶段的转录因子,发现Crem,Arid5a,Fosl1和Klf6在受损的背根神经节神经元中表达上调,且对神经突起的生长是必须的。另外分析了核心转录因子Atf3的表达及调控活性,并对其上游调控因子和下游的靶基因做了预测及分析,建立了背根神经节神经元轴突再生过程中的调控网络。但该调控网络仍需进一步的验证,尤其是Atf3上游的调控关系。另外,神经元受损后免疫相关或疼痛相关的核心网络也需要进一步分析,如果能找到其过程中的关键因子,对于之后临床上的神经损伤修复治疗会更有帮助。
原文链接:https://doi.org/10.4103/1673-5374.366494
参考文献
[1] Gu X, Ding F, Yang Y, et al. Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration. Prog Neurobiol. 2011;93(2):204-230.
[2] Zheng GX, Terry JM, Belgrader P, et al. Massively parallel digital transcriptional profiling of single cells. Nat Commun. 2017;8:14049.
[3] Renthal W, Tochitsky I, Yang L, et al. Transcriptional reprogramming of distinct peripheral sensory neuron subtypes after axonal injury. Neuron. 2020;108:128-144.e9(1).
[4] Wang K, Wang S, Chen Y, et al. Single-cell transcriptomic analysis of somatosensory neurons uncovers temporal development of neuropathic pain. Cell Res. 2021;31(8):904-918.
[5] Van Den Brink SC, Sage F, Vértesy Á, et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nat Methods. 2017;14(10):935-936
[6] Chandran V, Coppola G, Nawabi H, et al. A systems-level analysis of the peripheral nerve intrinsic axonal growth program. Neuron. 2016;89(5):956-970.
[7] Xu Y, Yu S, Shu Q, et al. Upregulation of CREM-1 relates to retinal ganglion cells apoptosis after light-induced damage in vivo. J Mol Neurosci. 2014;52(3):331-338.
[8] Fernandes KA, Harder JM, Kim J, et al. JUN regulates early transcriptional responses to axonal injury in retinal ganglion cells. Exp Eye Res. 2013;112:106-117
[9] Steketee MB, Oboudiyat C, Daneman R, et al. Regulation of intrinsic axon growth ability at retinal ganglion cell growth cones. Invest Ophthalmol Vis Sci. 2014;55(7):4369-4377.
[10] Nyati KK, Agarwal RG, Sharma P, et al. Arid5a regulation and the roles of Arid5a in the inflammatory response and disease. Front Immunol. 2019;10:2790.
[11] Seijffers R, Mills CD, Woolf CJ. ATF3 increases the intrinsic growth state of DRG neurons to enhance peripheral nerve regeneration. J Neurosci. 2007;27(30):7911-7920.

第一作者赵莉莉2021年毕业于南京大学模式动物研究所,2022年加入南通大学神经再生重点实验室顾晓松团队。

通讯作者顾晓松教授,多年来主要从事神经损伤与修复方面的研究工作,主持国家杰出青年科学基金、国家863重大专项课题、国家973计划子项目、国家自然科学基金、江苏省自然科学基金重点项目等研究课题十余项。近年来在国内外学术刊物上发表论文50多篇,主编和参编出版专著6部;研究成果获江苏省科技进步二、三等奖;获中国发明专利3项。2015年当选中国工程院院士。





