NRR:中国首都医科大学吉训明院士团队揭示间歇性低氧对血管性认知障碍与痴呆的防治作用:从脑血流恢复到认知功能保护
作者:金飞扬
血管性认知障碍与痴呆(vascular cognitive impairment and dementia,
VCID)是继阿尔茨海默病之后第二大痴呆病因,主要影响老年人,由脑血管功能障碍及脑血流(cerebral blood flow, CBF)不足引起 [1-3]。脑血流不足显著损害记忆和执行功能,最终导致日常生活能力和生活质量的严重下降 [4]。尽管现有治疗主要针对血管风险因素和症状管理,但针对根本病因的有效治疗仍缺乏 [5-8]。慢性脑供血不足是血管性认知障碍与痴呆的核心病理机制,恢复脑血流被认为是关键治疗靶点 [9, 10]。
间歇性低氧(intermittent hypoxia, IH)被证明能够促进血管生成并增强脑血流 [11],但其在血管性认知障碍与痴呆模型中的疗效尚未明确。双侧颈总动脉狭窄(bilateral common carotid artery stenosis,
BCAS)是构建血管性认知障碍与痴呆小鼠模型的常用方法,能有效诱导慢性脑供血不足并模拟疾病进展 [12]。然而,当前模型多采用单一病理环境,未能充分模拟血管性认知障碍与痴呆的共病特征,如高血压、糖尿病和肥胖等,这可能限制了研究的临床转化性 [13-17]。此次实验拟通过结合双侧颈总动脉狭窄手术和老龄化相关风险因素,构建更具临床相关性的血管性认知障碍与痴呆模型,评估间歇性低氧在改善脑血流、认知功能及病理共病条件下疗效的潜力。
中国首都医科大学吉训明院士团队在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Intermittent hypoxic perconditioning improves cognitive function in a
mouse model of vascular cognitive impairment and dementia with comorbidities by
recovering cerebral blood flow”的研究。实验通过双侧颈总动脉狭窄手术建立血管性认知障碍与痴呆模型,继而探索了间歇性低氧对改善脑血流、微循环和认知功能的影响。结果表明,间歇性低氧增强了血管性认知障碍与痴呆小鼠的脑血流和微循环,改善了认知功能,且间歇性低氧“期适应”的疗效优于“预适应”。此外,蛋白质组学分析发现,间歇性低氧通过线粒体保护作用改善了认知功能。该研究为间歇性低氧作为血管性认知障碍与痴呆的潜在非侵入性治疗方法提供了科学依据。金飞扬、田正明和关玉莹为论文共同第一作者,吉训明教授和刘佳副教授为论文通讯作者。
1间歇性低氧增强前额叶皮质和海马区的微循环,促进血管生成,无神经血管损伤
为评估间歇性低氧的安全性,吉训明等首先评估了其对神经血管的影响,小鼠每日接受10次5min的低氧暴露(13% O2)与5min常氧交替,持续14d(图1A)。与对照组相比,间歇性低氧显著增加了前额叶皮质和海马的脑血流和氧饱和度,未伴随血管损伤或神经细胞退化(图1B–E),表明间歇性低氧能改善脑代谢而不引起慢性神经血管损伤。
前额叶皮质和海马是重要的认知相关脑区,因此,实验进一步评估了间歇性低氧处理后的脑微循环。通过注射Lectin标记血管内皮并进行形态学分析(图1F和G),发现间歇性低氧组小鼠在前额叶皮质和海马的血管密度和分支点数量显著增加。通过对脑组织切片的定量分析,血管长度、面积、体积及分支点数量在间歇性低氧组小鼠中明显增加(图1H–O)。这些结果表明,间歇性低氧通过促进血管生成增强了小鼠脑部的血流供应,从而改善了微循环。
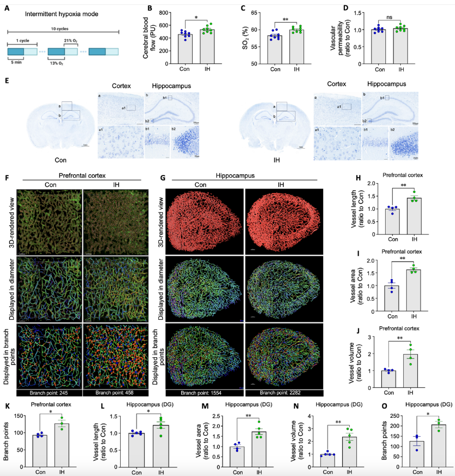
图1间歇性低氧在不引起神经血管损伤的情况下增强了前额叶皮质和海马的微循环
2间歇性低氧减轻血管性认知障碍与痴呆小鼠模型的认知损伤
为研究间歇性低氧对血管性认知障碍与痴呆模型小鼠的认知保护作用,吉训明等采用双侧颈总动脉狭窄手术建立血管性认知障碍与痴呆模型(图2A)。双侧颈总动脉狭窄小鼠术后脑血流显著降低,且新物体识别测试和水迷宫测试显示认知功能严重受损(图2B–F)。研究发现,间歇性低氧的预适应(间歇性低氧 + 血管性认知障碍与痴呆组)和期适应(血管性认知障碍与痴呆 + 间歇性低氧组)均能显著改善小鼠的认知功能,尤其是期适应组(图2G–K)。这些结果表明,术后间歇性低氧比术前预处理更有效地减轻了认知损伤。
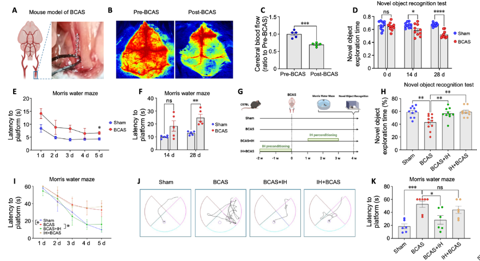
图2间歇性低氧改善了血管性认知障碍与痴呆小鼠的认知功能障碍
3间歇性低氧增强脑血流并改善微循环,从而改善认知功能
在双侧颈总动脉狭窄手术后,间歇性低氧期适应显著改善了小鼠前额叶皮质和海马的脑血流,并减轻了胼胝体纤维损伤(图3A–D)。对小鼠认知功能与皮质、海马血流灌注以及胼胝体白质完整性之间进行了线性回归分析表明,小鼠认知功能的提高与海马、皮质的血流量以及胼胝体的白质完整性呈正相关(图3E–J)。此外,通过三维重建微血管图像分析,发现前额叶皮质和海马齿状回区的血管长度、面积、体积和分支点数量在血管性认知障碍与痴呆 + 间歇性低氧组小鼠中均明显增加(图3K–S),进一步验证了间歇性低氧在改善微循环方面的作用。
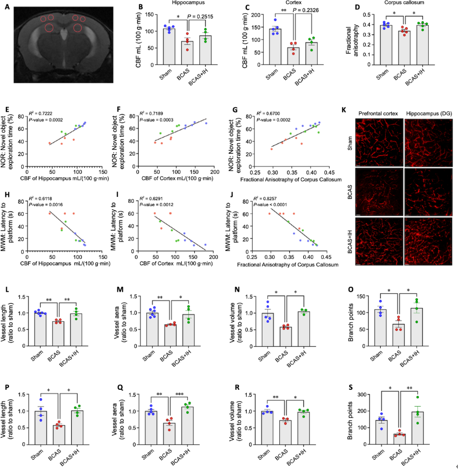
图3间歇性低氧改善了血管性认知障碍与痴呆小鼠认知相关脑区的脑灌注和微循环
4间歇性低氧在伴随常见风险因素的血管性认知障碍与痴呆小鼠模型中仍具有保护作用
为更好地模拟临床情形,吉训明等结合了双侧颈总动脉狭窄手术与高脂高果糖(High-fat, high-fructose, HFF)饮食,建立了具有常见代谢风险因素(如肥胖和糖尿病)的血管性认知障碍与痴呆小鼠模型。虽然高脂高果糖饮食导致小鼠体重增加和血糖升高(图4A–C),间歇性低氧后处理仍能改善小鼠的脑血流并减轻由高脂高果糖饮食和双侧颈总动脉狭窄引发的认知缺损(图4H–L)。尽管高脂高果糖饮食对代谢参数的影响未完全逆转,间歇性低氧有效改善了因这些因素引起的认知功能障碍。
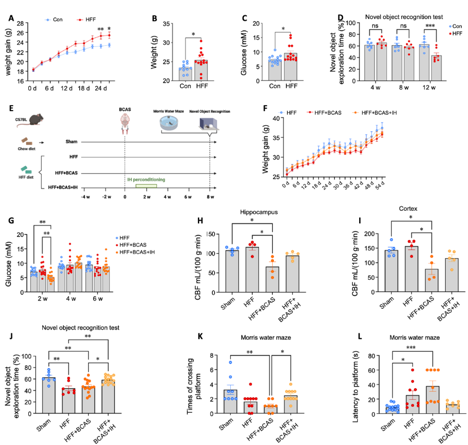
图4间歇性低氧并改善了具有合并风险因素的血管性认知障碍与痴呆的脑血流和认知功能
5间歇性低氧通过调节线粒体呼吸链相关蛋白改善脑代谢并保护认知功能
为揭示间歇性低氧的分子机制,吉训明等通过蛋白质组学分析发现,间歇性低氧显著上调了与血管生成、细胞增殖和线粒体功能相关的多种蛋白质表达,特别是线粒体复合体I相关蛋白NDUFB8和Cox IV的表达(图5A–F及图6A–G)。进一步的功能分析显示,间歇性低氧提高了线粒体复合体I的活性(图6D),并改善了小鼠脑皮质中的Ndufb8表达(图6E–G)。这些结果表明,间歇性低氧通过增强线粒体代谢能力,促进了更持久的神经保护反应,从而帮助保护了血管性认知障碍与痴呆小鼠的认知功能。
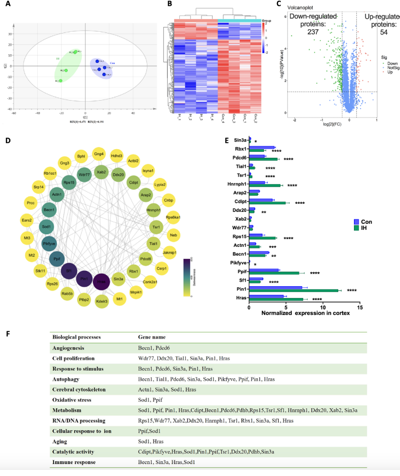
图5间歇性低氧干预后小鼠皮质蛋白质组学研究蛋白表达的变化
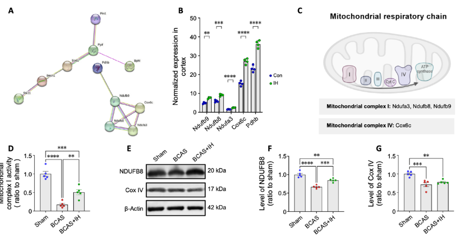
图6间歇性低氧改变了皮质中多种线粒体呼吸链蛋白的表达水平,并增强了复合物I的活性
吉训明等发现,间歇性低氧能够有效改善血管性认知障碍与痴呆小鼠的脑血流、微循环及认知功能,尤其在伴随高脂肪高果糖饮食等代谢风险因素的共病模型中。研究表明,间歇性低氧通过改善脑血流可能增强线粒体代谢能力,从而提供持续的神经保护。这一发现为间歇性低氧作为治疗血管性认知障碍与痴呆的潜在非侵入性策略提供了科学依据。
然而,尽管间歇性低氧在改善脑血流和认知功能方面表现出潜力,仍有不足之处。首先当前使用的双侧颈总动脉狭窄模型虽然能够模拟急性脑供血不足,但与人类慢性脑供血不足的进展不完全一致,限制了研究的临床相关性。未来,采用更具临床相关性的动物模型,如慢性颈动脉狭窄模型,将有助于更好地评估间歇性低氧疗效。此外,研究未能深入探讨间歇性低氧的具体机制,尤其是衰老、性别等因素对间歇性低氧疗效的影响。蛋白质组学分析表明,间歇性低氧可能通过调节线粒体复合体I相关蛋白来增强线粒体代谢,但这一机制仍需进一步验证。未来的研究应结合不同年龄、性别及代谢疾病因素,全面评估间歇性低氧在临床中的应用潜力。
总之,尽管此次研究在间歇性低氧对血管性认知障碍与痴呆治疗的潜力上取得了积极进展,仍需进一步探索其机制和临床适应性,以推动这一策略向临床转化。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00716
参考文献
[1] O'brien JT, Thomas A. Vascular dementia. Lancet. 2015;386(10004):1698-1706.
[2] Corriveau RA, Bosetti F, Emr M, et al. The science of vascular contributions to cognitive impairment and dementia (VCID): a framework for advancing research priorities in the cerebrovascular biology of cognitive decline. Cell Mol Neurobiol. 2016;36(2):281-288.
[3] Van Der Flier WM, Skoog I, Schneider JA, et al. Vascular cognitive impairment. Nat Rev Dis Primers. 2018;4:18003.
[4] Skrobot OA, Black SE, Chen C, et al. Progress toward standardized diagnosis of vascular cognitive impairment: Guidelines from the Vascular Impairment of Cognition Classification Consensus Study. Alzheimers Dement. 2018;14(3):280-292.
[5] Godyń J, Jończyk J, Panek D, et al. Therapeutic strategies for Alzheimer's disease in clinical trials. Pharmacol Rep. 2016;68(1):127-138.
[6] Moretti A, Gorini A, Villa RF. Pharmacotherapy and prevention of vascular dementia. CNS Neurol Disord Drug Targets. 2011;10(3):370-390.
[7] Wolters FJ, Ikram MA. Epidemiology of vascular dementia. Arterioscler Thromb Vasc Biol. 2019;39(8):1542-1549.
[8] Sinha K, Sun C, Kamari R, et al. Current status and future prospects of pathophysiology-based neuroprotective drugs for the treatment of vascular dementia. Drug Discov Today. 2020;25(4):793-799.
[9] Dichgans M, Leys D. Vascular cognitive impairment. Circ Res. 2017;120(3):573-591.
[10] Poh L, Sim WL, Jo DG, et al. The role of inflammasomes in vascular cognitive impairment. Mol Neurodegener. 2022;17(1):4.
[11] Guan Y, Gu Y, Shao H, et al. Intermittent hypoxia protects against hypoxic-ischemic brain damage by inducing functional angiogenesis. J Cereb Blood Flow Metab. 2023;43(10):1656-1671.
[12] Washida K, Hattori Y, Ihara M. Animal models of chronic cerebral hypoperfusion: from mouse to primate. Int J Mol Sci. 2019;20(24):6176.
[13] Hainsworth AH, Allan SM, Boltze J, et al. Translational models for vascular cognitive impairment: a review including larger species. BMC Med. 2017;15(1):16.
[14] Fisher M, Feuerstein G, Howells DW, et al. Update of the stroke therapy academic industry roundtable preclinical recommendations. Stroke. 2009;40(6):2244-2250.
[15] Kilkenny C, Browne WJ, Cuthill IC, et al. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 2010;8(6):e1000412.
[16] Duncombe J, Kitamura A, Hase Y, et al. Chronic cerebral hypoperfusion: a key mechanism leading to vascular cognitive impairment and dementia. Closing the translational gap between rodent models and human vascular cognitive impairment and dementia. Clin Sci (Lond). 2017;131(19):2451-2468.
[17] Fisher M, Stroke Therapy Academic Industry Roundtable. Recommendations for advancing development of acute stroke therapies: Stroke Therapy Academic Industry Roundtable 3. Stroke. 2003;34(6):1539-1546.





