NRR:中国上海中医药大学许东升团队提出脊髓损伤中多目标神经环路重建与增强的重要性
撰文:曹凌云,陈思韵,王舒萍,郑娅,许东升
脊髓损伤后,感觉运动环路的受损会导致运动、感觉、躯体以及自主神经系统的功能障碍。这些功能障碍可能严重影响患者的日常生活和康复进程。而干预的时间窗局限性和干预方法的限制会导致功能恢复的瓶颈。目前,针对脊髓损伤的康复方法旨在利用先进的技术优化残余功能,并降低继发性并发症的风险。同时,在推动神经环路修复与重建的过程中,研究人员已开发出多种技术,旨在不同阶段实施有效干预。中国上海中医药大学许东升团队深刻认识到当前状况尚存诸多不足,强烈呼吁将关注焦点迅速转向改善功能的康复治疗,深入探究受损部位的神经保护机制、神经修复技术及神经再生潜能。此外,考虑到神经元部分失活的慢性阶段和干预措施的有限有效性,作者强调早期干预的重要性,以确保及时有效的治疗和功能恢复。
许东升等在《中国神经再生研究(英文)》(Neural Regeneration
Research)上发表了题为“Multi-target neural
circuit reconstruction and enhancement in spinal cord injury”的综述文章,探讨了多靶区、任务导向干预框架中时机选择的重要性,并强调了早期干预在脊髓损伤治疗结果和康复过程中起到的关键作用。
目前,脊髓损伤治疗的主要重点在于保护神经系统、促进神经元修复和再生以及改善微环境。在急性期的治疗方案中,首要措施为实施手术干预,清除引起脊髓受压的液体或组织,以恢复脊髓的正常功能。同时,为减轻炎症并保护神经元,将同步采取药物干预措施,确保患者得到全面而有效的治疗。在慢性期,单独依赖自身的恢复能力来显著改善患者的功能状态,已证明为一项极具挑战性的任务。鉴于此,研究者们致力于利用神经可塑性的原理,对慢性脊髓损伤患者进行精准的神经调控治疗,以期为患者提供更为有效的修复和重建途径。
1 治疗手段
脊髓功能的恢复有赖于神经环路的完整性和重建程度。近年来,基于神经环路的神经调控技术因其能够强化残余通路并促进神经重塑而备受瞩目。除了手术、药物治疗、干细胞移植以及生物材料支持外,任务导向训练和物理因子神经调控技术正逐步展现出其显著且积极的治疗效果,为患者提供了更为多元化的康复选择(表1-4)。
2 多靶区治疗:重建神经环路的关键
在脊髓半横断情况下,由于脊髓上段的神经元能够投射到下段的神经元,从而促进了患者部分功能的恢复。研究表明,在脊髓半横断情况下,源自未损伤侧的轴突也能够绕过受损区域,与位于损伤部位远端的神经元建立连接。然而,中枢神经元损伤后的自发再生轴突的能力有限,新再生轴突的零星和无序生长将进一步影响脊髓损伤修复的效果。
为了解决单目标刺激的不足,多靶区刺激的概念应运而生。基于联想可塑性的希伯来理论,配对联想刺激将针对初级运动皮质的经颅磁刺激与对侧肢体的周围神经刺激结合起来。同时激活突触前和突触后神经元的,增强脊髓水平的突触强度,改善肌肉运动控制,已成为针对不完全慢性脊髓损伤患者的一种新型临床康复干预方法。
受配对联想刺激原理的启发,加上对潜在神经环路的了解,作者团队通过采用将大脑皮质磁刺激和神经根磁刺激相结合的协同增强策略,最大限度地激活感觉运动环路。这种策略不仅能促进运动功能的恢复,还能改善整体康复效果,为脊髓损伤急性期或关键期的干预策略提供了希望。至关重要的一点是,它能够以安全、可靠的方式实现早期的神经保护、唤醒与激活。
3 时机:神经损伤早期康复成功的关键因素
治疗时机对治疗效果起着至关重要的作用,但确定最佳干预时机仍需要更多的临床证据。在临床实践中,神经调控通常应用于脊髓损伤后的慢性期,以确保患者安全和治疗效果。基础研究方面,由于脊髓损伤后修复机制的复杂性,其在时间干预方面尚未实现高度一致性。而脊髓损伤后,短期及长期内均会导致皮质-脊髓环路的结构与连接发生改变。受伤后,相应皮质和其他区域的自发神经元活动会立即减少。从长远来看,神经元失活导致的有限再生能力,以及胶质瘢痕组织造成的物理障碍,极大地阻碍了损伤后的神经再生和功能恢复应对这些挑战,神经调控包括2种主要策略。第一种策略旨在促进神经元修复和髓鞘再生。第二种策略的重点是优化受影响区域的微环境,这一因素对于加强整体康复过程同样重要。
4讨论与启发
在脊髓损伤的治疗过程中,不同阶段的损伤状态需要相应的神经调节策略。具体而言,脊髓损伤后,神经元修复的效率和微环境的状况在急性、亚急性及慢性阶段均呈现显著差异。因此,基于这些差异,在不同的时间点采取针对性的神经调控策略,将直接影响患者的治疗效果和康复进程。整合任务导向理疗和多靶点刺激,可进一步增强功能康复(图 1)。图中红点的坐标代表了不同方法在各个阶段的适用性。然而,目前的研究进展缺乏实证数据来支持这一建议图。因此,该图代表了未来多靶区、多任务模式和多阶段干预的概念框架。
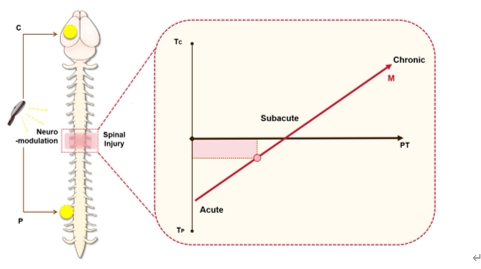
图1 不同阶段的脊髓损伤需要量身定制的神经调控策略
5总结与展望
此次综述着重指出了脊髓损伤所呈现出的复杂性与严峻挑战,并深刻揭示了其对感觉运动环路以及运动、感觉、躯体和自主神经系统所产生的深远影响。尽管康复策略在优化残余功能和促进独立性方面取得了一定进步,然而,由于干预的时机选择以及神经损伤的严重程度,当前的治疗模式仍面临显著的局限性。神经调控技术,尤其是依托电刺激与磁刺激等先进手段,已成为一项极具潜力的方法,用于增强神经再生能力,促进神经元的保护与恢复,并在大脑皮质和皮质脊髓束的神经环路重组过程中发挥关键作用。采用多靶点、早期干预的神经调控策略,为克服功能恢复障碍提供了前景广阔的新视角,凸显了在治疗规划中采用及时、任务导向且高度时间相关性方法的必要性,这一策略有助于更有效地应对功能恢复方面的挑战。文章阐述了这些干预措施的益处,呼吁向更有效的康复方法转变,重点关注神经保护、修复和受损连接的再生,强调早期干预在影响脊髓损伤治疗结果和康复过程中的关键作用。
许东升等专注于探讨基于感觉运动环路的神经调控机制,而对于其他环路和机制下的神经调控,尚需进行更为深入的探索和研究。同时,随着生物工程学等技术的不断发展,神经调控的研究和应用领域已不再局限于其传统范畴,特别是在刺激性能和刺激模式的优化上,仍有待进一步的改进和完善。此外,鉴于当前在早期干预方面的研究尚显不足,研究学者亟需扩大样本量,以更全面地验证神经调控技术的有效性和可行性。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00434
参考文献
[1] Leszczyńska K, Wincek A, Fortuna W, et al. Treatment of patients with cervical and upper thoracic incomplete spinal cord injury using repetitive transcranial magnetic stimulation. Int J Artif Organs. 2020;43(5):323-331.
[2] Mendonça T, Brito R, Luna P, et al. Repetitive transcranial magnetic stimulation on the modulation of cortical and spinal cord excitability in individuals with spinal cord injury. Restor Neurol Neurosci. 2021;39(4):291-301.
[3] Wincek A, Huber J, Leszczyńska K, et al. The long-term effect of treatment using the transcranial magnetic stimulation rtms in patients after incomplete cervical or thoracic spinal cord injury. J Clin Med. 2021;10(13):2975.
[4] Mittal N, Majdic BC, Peterson CL. Intermittent theta burst stimulation modulates biceps brachii corticomotor excitability in individuals with tetraplegia. J Neuroeng Rehabil. 2022;19(1):73.
[5] Krogh S, Aagaard P, Jønsson AB, et al. Effects of repetitive transcranial magnetic stimulation on recovery in lower limb muscle strength and gait function following spinal cord injury: a randomized controlled trial. Spinal Cord. 2022;60(2):135-141.
[6] Kesikburun S, Uran Şan A, Yaşar E, et al. The effect of high-frequency repetitive transcranial magnetic stimulation on motor recovery and gait parameters in chronic incomplete spinal cord injury: A randomized-controlled study. Turk J Phys Med Rehabil. 2023;69(3):275-285.
[7] Li E, Yan R, Qiao H, et al. Combined transcriptomics and proteomics studies on the effect of electrical stimulation on spinal cord injury in rats. Heliyon. 2024;10(1):e23960.
[8] Singh G, Keller A, Lucas K, et al. Safety and feasibility of cervical and thoracic transcutaneous spinal cord stimulation to improve hand motor function in children with chronic spinal cord injury. Neuromodulation. 2024;27(4):661-671.
[9] Mukhametova E, Militskova A, Biktimirov A, et al. Consecutive transcutaneous and epidural spinal cord neuromodulation to modify clinical complete paralysis-the proof of concept. Mayo Clin Proc Innov Qual Outcomes. 2024;8(1):1-16.
[10] Tajali S, Iwasa SN, Sin V, et al. The orthotic effects of different functional electrical stimulation protocols on walking performance in individuals with incomplete spinal cord injury: a case series. Top Spinal Cord Inj Rehabil. 2023;29(Suppl):142-152.
[11] Alam M, Ling YT, Rahman MA, et al. Restoration of over-ground walking via non-invasive neuromodulation therapy: a single-case study. J Clin Med. 2023;12(23):7362.
[12] Balbinot G, Li G, Gauthier C, et al. Functional electrical stimulation therapy for upper extremity rehabilitation following spinal cord injury: a pilot study. Spinal Cord Ser Cases. 2023;9(1):11.
[13] Anderson KD, Korupolu R, Musselman KE, et al. Multi-center, single-blind randomized controlled trial comparing functional electrical stimulation therapy to conventional therapy in incomplete tetraplegia. Front Rehabil Sci. 2022;3:995244.
[14] Krishnan VS, Shin SS, Belegu V, et al. Multimodal evaluation of TMS - induced somatosensory plasticity and behavioral recovery in rats with contusion spinal cord injury. Front Neurosci. 2019;13:387.
[15] Li Z, Yao F, Cheng L, et al. Low frequency pulsed electromagnetic field promotes the recovery of neurological function after spinal cord injury in rats. J Orthop Res. 2019;37(2):449-456.
[16] Marufa SA, Hsieh TH, Liou JC, et al. Neuromodulatory effects of repetitive transcranial magnetic stimulation on neural plasticity and motor functions in rats with an incomplete spinal cord injury: A preliminary study. PLoS One. 2021;16(6):e0252965.
[17] Michel-Flutot P, Jesus I, Vanhee V, et al. Effects of chronic high-frequency rTMS protocol on respiratory neuroplasticity following C2 spinal cord hemisection in rats. Biology (Basel). 2022;11(3):473.
[18] Lee KZ, Vinit S. Modulatory effect of trans-spinal magnetic intermittent theta burst stimulation on diaphragmatic activity following cervical spinal cord contusion in the rat. Spine J. 2024;24(2):352-372.
[19] Kondiles BR, Murphy RL, Widman AJ, et al. Cortical stimulation leads to shortened myelin sheaths and increased axonal branching in spared axons after cervical spinal cord injury. Glia. 2023;71(8):1947-1959.
[20] Shen X, Sun T, Li Z, et al. Generation of locomotor‑like activity using monopolar intraspinal electrical microstimulation in rats. Exp Ther Med. 2023;26(6):560.
[21] Hu R, He K, Chen B, et al. Electroacupuncture promotes the repair of the damaged spinal cord in mice by mediating neurocan-perineuronal net. CNS Neurosci Ther. 2024;30(1):e14468.
[22] Scheuber MI, Guidolin C, Martins S, et al. Electrical stimulation of the cuneiform nucleus enhances the effects of rehabilitative training on locomotor recovery after incomplete spinal cord injury. Front Neurosci. 2024;18:1352742.
[23] Lai BQ, Wu RJ, Han WT, et al. Tail nerve electrical stimulation promoted the efficiency of transplanted spinal cord-like tissue as a neuronal relay to repair the motor function of rats with transected spinal cord injury. Biomaterials. 2023;297:122103.
[24] Bacova M, Bimbova K, Kisucka A, et al. Epidural oscillating field stimulation increases axonal regenerative capacity and myelination after spinal cord trauma. Neural Regen Res. 2022;17(12):2730-2736.
[25] Liu JL, Chen ZH, Wu RJ, et al. Effects of tail nerve electrical stimulation on the activation and plasticity of the lumbar locomotor circuits and the prevention of skeletal muscle atrophy after spinal cord transection in rats. CNS Neurosci Ther. 2024;30(3):e14445.
[26] Hofer AS, Scheuber MI, Sartori AM, et al. Stimulation of the cuneiform nucleus enables training and boosts recovery after spinal cord injury. Brain. 2022;145(10):3681-3697.
