NRR:华中科技大学同济医学院附属同济医院麻醉科梅伟团队揭示G蛋白偶联受体39在神经病理性疼痛中的作用
撰文:张龙庆,梅伟
既往研究表明,G蛋白偶联受体39可在中枢神经系统中广泛表达[1]。此外,G蛋白偶联受体39作为锌离子(Zn2+)的受体之一,可介导Zn2+对细胞的多种调控作用[2-4]。还有研究发现,G蛋白偶联受体39的激活可抑制细胞炎性活动[5],改善氧化应激[6]、线粒体功能障碍[7]以及内质网应激[7],并促进伤口愈合[8],还可改善炎症性肠病[9]、抑郁[10]和脑卒中[11]的症状。然而,G蛋白偶联受体39在神经病理性疼痛中的作用尚不清楚。
最近,中国华中科技大学同济医学院附属同济医院麻醉科的梅伟团队在《中国神经再生研究(英文版)》(Neural Regeneration Research)上发表了题为“Activation of G-protein-coupled receptor 39 reduces neuropathic pain in a rat model”的研究。研究通过构建大鼠坐骨神经分支保留性损伤建立神经病理性疼痛模型,可见其脊髓背角神经元和小胶质细胞中G蛋白偶联受体39表达水平显著下降。经鞘内注射G蛋白偶联受体39特异性激动剂TC-G 1008可显著缓解坐骨神经分支保留性损伤大鼠的机械性痛觉异常,改善脊髓线粒体生物发生功能,并缓解神经炎症。同时G蛋白偶联受体39 siRNA,sirtuin 1特异性抑制剂Ex-527以及过氧化物酶体增殖物激活受体γ共激活因子1α siRNA均可抑制TC-G 1008对坐骨神经分支保留性损伤的作用。
梅伟等首先使用雄性SD大鼠构建了坐骨神经分支保留性损伤模型。免疫荧光染色发现,其脊髓背角神经元和小胶质细胞中G蛋白偶联受体39的表达水平显著下降(图1);免疫印迹和免疫荧光结果显示,坐骨神经分支保留性损伤大鼠脊髓sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号被显著抑制;定量PCR结果证实,其线粒体生物发生功能被显著抑制(图2)。

图1 G蛋白偶联受体39在脊髓背角的细胞定位(图源: Zhang, et al., Neural Regen Res, 2024)

图2 坐骨神经分支保留性损伤抑制大鼠脊髓中sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号以及线粒体生物发生功能(图源: Zhang, et al., Neural Regen Res, 2024)
为探究激活脊髓G蛋白偶联受体39能否缓解坐骨神经分支保留性损伤大鼠的神经病理性疼痛,以鞘内注射不同剂量的G蛋白偶联受体39特异性激动剂TC-G 1008。结果显示,鞘内单次注射20或50 μg TC-G 1008均可显著改善坐骨神经分支保留性损伤大鼠的机械性痛觉异常,且二者的镇痛效果无明显差异(图3)。而鞘内多次注射20 μg TC-G 1008还可显著激活下游sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号分子,改善坐骨神经分支保留性损伤大鼠的线粒体生物发生功能,抑制脊髓多种促炎因子的表达(图4)。
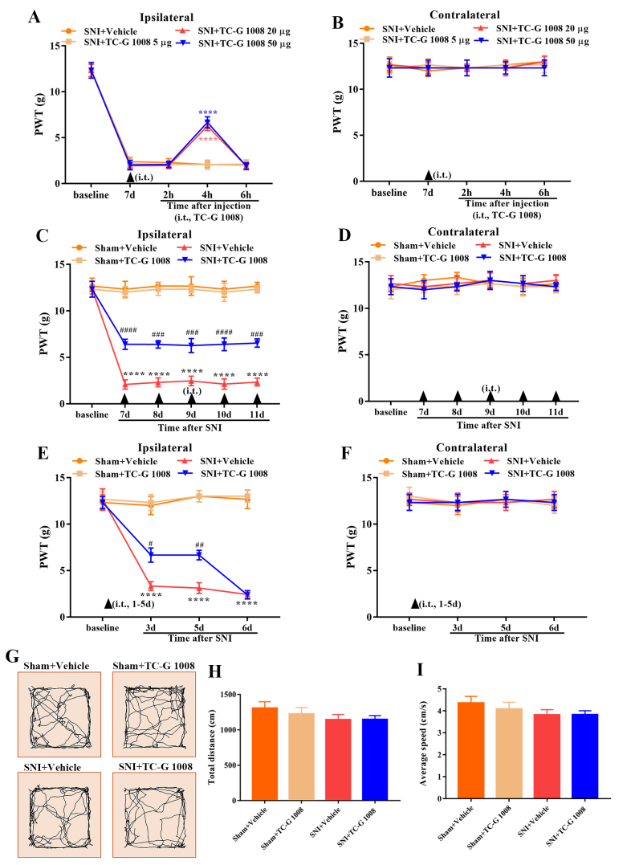
图3 鞘内注射TC-G 1008可缓解坐骨神经分支保留性损伤大鼠的机械性痛觉异常(图源:Zhang, et al., Neural Regen Res, 2024)

图4鞘内注射TC-G 1008可激活sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号,改善坐骨神经分支保留性损伤大鼠的线粒体生物发生功能,并抑制脊髓神经炎症(图源:Zhang, et al., Neural Regen Res, 2024)
为进一步证实G蛋白偶联受体39是否介导了TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用,提前鞘内注射G蛋白偶联受体39 siRNA,结果显示,其可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用(图5),还可逆转脊髓中sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能以及神经炎症的调控作用(图6)。

图5鞘内注射G蛋白偶联受体39 siRNA可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用(图源:Zhang, et al., Neural Regen Res, 2024)
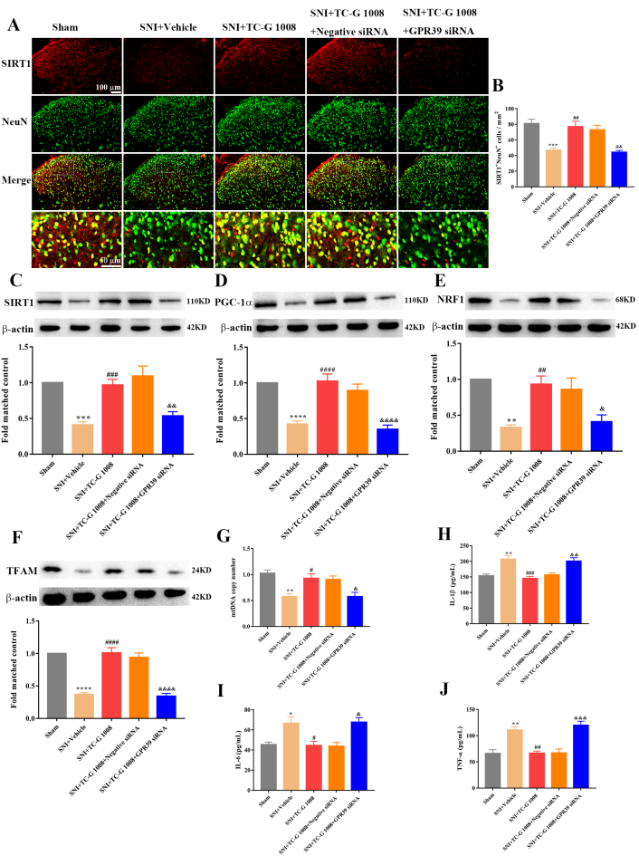
图6鞘内注射G蛋白偶联受体39 siRNA可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠脊髓sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能以及神经炎症的调控作用(图源:Zhang, et al., Neural Regen Res, 2024)
为探究sirtuin 1是否介导了TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用,使用了sirtuin 1特异性抑制剂EX-527,结果显示Ex-257可显著逆转TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用(图7),也可逆转TC-G 1008 对坐骨神经分支保留性损伤大鼠脊髓过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能和神经炎症的调控作用(图8)。

图7鞘内注射EX-527可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用(图源:Zhang, et al., Neural Regen Res, 2024)

图8鞘内注射Ex-527可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠脊髓过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能以及神经炎症的调控作用(图源:Zhang, et al., Neural Regen Res, 2024)
最后,为探究过氧化物酶体增殖物激活受体γ共激活因子1α是否介导了TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用,通过鞘内注射过氧化物酶体增殖物激活受体γ共激活因子1α siRNA,可见TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用被逆转(图9),同时TC-G 1008 对坐骨神经分支保留性损伤大鼠脊髓过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能以及神经炎症的调控作用也被逆转(图10)。

图9鞘内注射过氧化物酶体增殖物激活受体γ共激活因子1α siRNA可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠的镇痛作用(图源:Zhang, et al., Neural Regen Res, 2024)
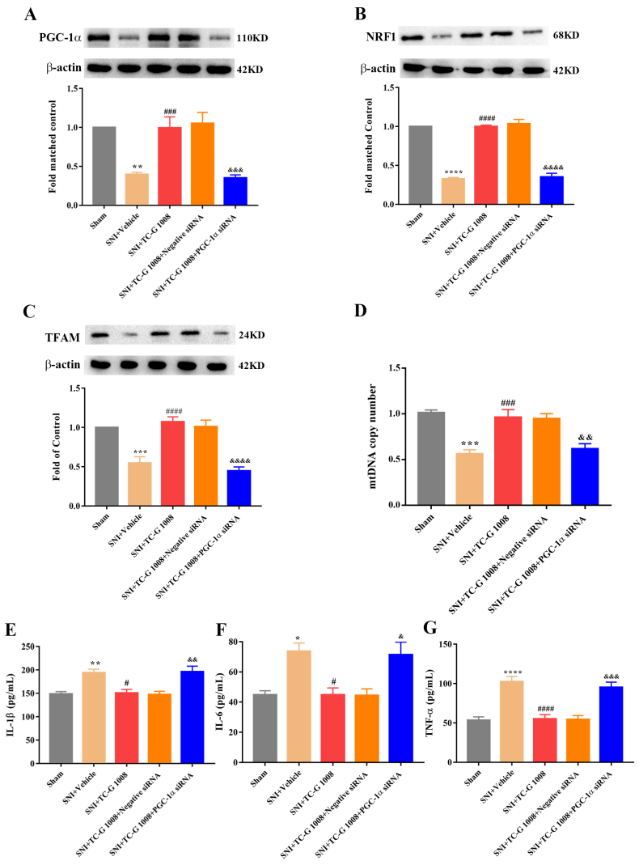
图10鞘内注射过氧化物酶体增殖物激活受体γ共激活因子1α siRNA可逆转TC-G 1008对坐骨神经分支保留性损伤大鼠脊髓过氧化物酶体增殖物激活受体γ共激活因子1α/核呼吸因子1/线粒体转录因子A信号、线粒体生物发生功能以及神经炎症的调控作用(图源:Zhang, et al., Neural Regen Res, 2024)
该研究首次发现脊髓G蛋白偶联受体39可参与坐骨神经分支保留性损伤大鼠神经病理性疼痛的发展,激活脊髓G蛋白偶联受体39可显著激活下游sirtuin 1/过氧化物酶体增殖物激活受体γ共激活因子1α信号通路,进而缓解坐骨神经分支保留性损伤大鼠的机械性痛觉异常,改善坐骨神经分支保留性损伤大鼠脊髓核呼吸因子1/线粒体转录因子A介导的线粒体生物发生功能和神经炎症。该研究为神经病理性疼痛的治疗提供了新的思路和靶点。
此次实验只关注了雄性大鼠,为了拓宽临床价值,未来应该考虑使用雌性大鼠,以探究性别因素能否影响G蛋白偶联受体39在神经病理性疼痛中的作用。此外,该研究的时间窗较短,仅观察坐骨神经分支保留性损伤后11d内的变化,为探究G蛋白偶联受体39在神经病理性疼痛中的长期作用,可尝试观察更长的时间。
原文链接:https://doi.org/10.4103/1673-5374.380905
参考文献
[1] Egerod KL, Holst B, Petersen PS, et al. GPR39 splice variants versus antisense gene LYPD1: expression and regulation in gastrointestinal tract, endocrine pancreas, liver, and white adipose tissue. Mol Endocrinol. 2007;21(7):1685-1698.
[2] Rychlik M, Mlyniec K. Zinc-mediated Neurotransmission in Alzheimer's Disease: A Potential Role of the GPR39 in Dementia. Curr Neuropharmacol. 2020;18(1):2-13.
[3] Depoortere I. GI functions of GPR39: novel biology. Curr Opin Pharmacol. 2012;12(6):647-652.
[4] Pan J, Huang X, Li Y, et al. Zinc protects against cadmium-induced toxicity by regulating oxidative stress, ions homeostasis and protein synthesis. Chemosphere. 2017;188:265-273.
[5] Xu Y, Wang M, Xie Y, et al. Activation of GPR39 with the agonist TC-G 1008 ameliorates ox-LDL-induced attachment of monocytes to endothelial cells. Eur J Pharmacol. 2019;858:172451.
[6] Mo F, Tang Y, Du P, et al. GPR39 protects against corticosterone-induced neuronal injury in hippocampal cells through the CREB-BDNF signaling pathway. J Affect Disord. 2020;272:474-484.
[7] Sánchez-Temprano A, Relova JL, Camiña JP, et al. Concurrent Akt, ERK1/2 and AMPK activation by obestatin inhibits apoptotic signaling cascades on nutrient-deprived PC12 cells. Cell Mol Neurobiol. 2022;42(5):1607-1614.
[8] Zhao H, Qiao J, Zhang S, et al. GPR39 marks specific cells within the sebaceous gland and contributes to skin wound healing. Sci Rep. 2015;5:7913.
[9] Hershfinkel M. The zinc sensing receptor, ZnR/GPR39, in health and disease. Int J Mol Sci. 2018;19(2):439.
[10] Starowicz G, Jarosz M, Frąckiewicz E, et al. Long-lasting antidepressant-like activity of the GPR39 zinc receptor agonist TC-G 1008. J Affect Disord. 2019;245:325-334.
[11] Xie S, Jiang X, Doycheva DM, et al. Activation of GPR39 with TC-G 1008 attenuates neuroinflammation via SIRT1/PGC-1α/Nrf2 pathway post-neonatal hypoxic-ischemic injury in rats. J Neuroinflammation. 2021;18(1):226.

第一作者:张龙庆,华中科技大学同济医学院附属同济医院麻醉科2020级博士,导师为梅伟教授,以第一作者身份发表SCI论文5篇。

通讯作者:梅伟,医学博士,三级教授,主任医师,博士研究生导师,2012年起任同济医院麻醉学教研室副主任。中华医学会麻醉学分会老年人麻醉学组副组长,中国医疗保健国际交流促进会区域麻醉分会副主任委员,中国医疗器械行业协会麻醉与围术期医学分会副主任委员,中国心胸血管麻醉学会围术期器官保护分会副主任委员,中国心胸血管麻醉学会超声分会副主任委员,湖北省医学会麻醉学分会委员。《中华麻醉学杂志》常务编委,《临床麻醉学杂志》编委,《国际麻醉学与复苏》杂志编委。主要研究方向为麻醉机理、神经阻滞麻醉和急性疼痛。获得国家自然科学基金5项,省部级课题3项。发表论文100余篇,其中第一和通讯作者SCI收录期刊50余篇,IF 10分以上8篇,最高单篇IF 19.227分。主编人民卫生出版社出版专著《超声定位神经阻滞图谱》,主译《儿童超声和神经刺激器引导区域麻醉图谱》。











