中国神经再生研究(英文版) ›› 2026, Vol. 21 ›› Issue (2): 821-832.doi: 10.4103/NRR.NRR-D-23-02108
• 原著:视神经损伤修复保护与再生 • 上一篇
间充质干细胞来源小细胞外囊泡可加强视网膜祖细胞移植治疗视网膜变性的效果
Mesenchymal stem cell–derived small extracellular vesicles enhance the therapeutic effect of retinal progenitor cells in retinal degenerative disease rats
Chunge Ren1, 2, #, Min Chen1, 2, #, Bangqi Ren1, 2, Yuxiao Zeng1, 2, Qiang Tan1, 2, Qiyou Li1, 2, Xue Zhang1, 2, Yajie Fang1, 2, Yixiao Zhou1, 2, Weitao Zhang1, 2, Fang Chen3, *, Baishijiao Bian1, 2, 4, 5, *, Yong Liu1, 2, 6, *
- 1 Southwest Hospital/Southwest Eye Hospital, Third Military Medical University (Army Medical University), Chongqing, China; 2 Key Lab of Visual Damage and Regeneration & Restoration of Chongqing, Chongqing, China; 3 Department of Medical Technology, Chongqing Medical and Pharmaceutical College, Chongqing, China; 4 Army 953 Hospital, Shigatse Branch of Xinqiao Hospital, Third Military Medical University (Army Medical University), Shigatse, Tibet Autonomous Region, China; 5 State Key Laboratory of Trauma and Chemical Poisoning, Third Military Medical University (Army Medical University), Chongqing, China; 6 Jinfeng Laboratory, Chongqing, China
摘要:
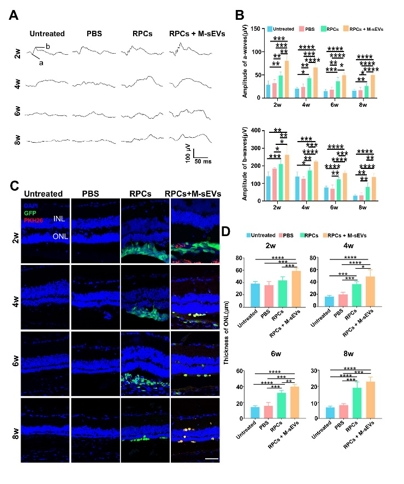
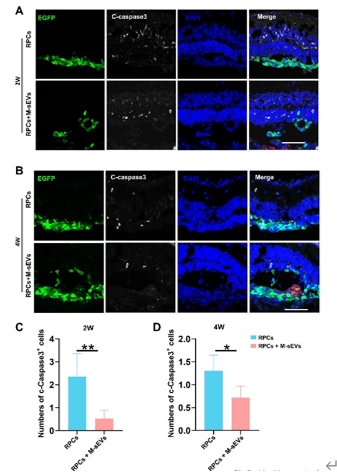
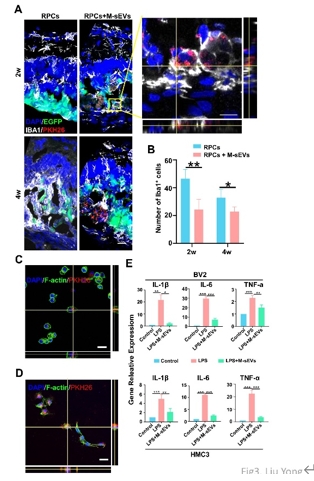
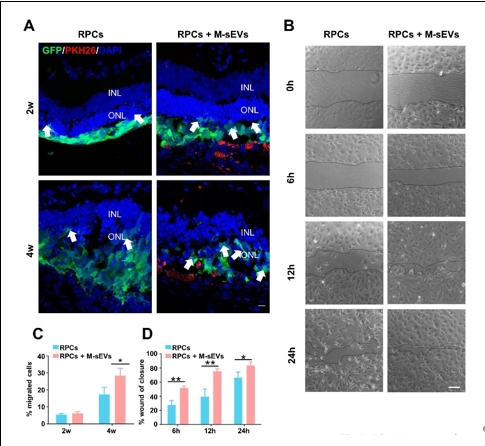
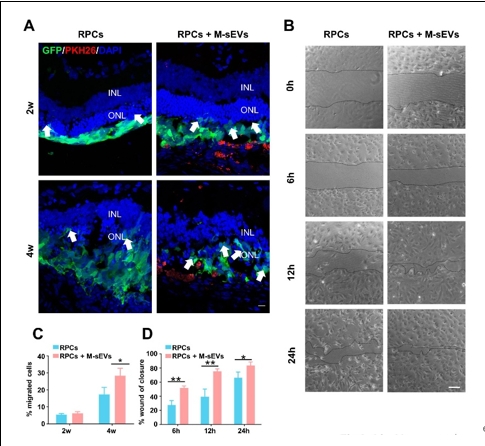
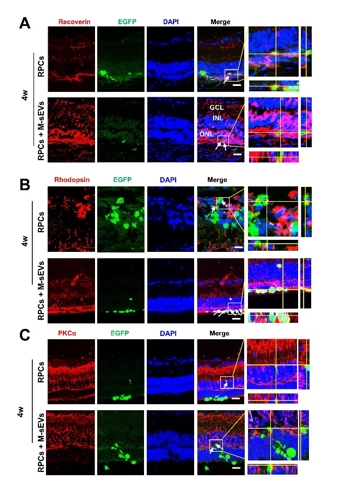
作者团队前期研究发现,间充质干细胞联合视网膜祖细胞移植可较好地治疗大鼠视网膜变性,而间充质干细胞发挥作用可能是由于其分泌各种神经营养因子以及细胞外囊泡等来实现对微环境中各类细胞的调控和交流。间充质干细胞来源的小细胞外囊泡由于其低免疫源性、低成瘤风险和易于运输等优势已被用于治疗各种神经系统疾病从而发挥抗炎,组织修复,免疫调控等作用。因此,探索联合移植间充质干细胞来源的小细胞外囊泡辅助视网膜祖细胞治疗视网膜变性这一新策略,有望为视网膜变性的干细胞治疗开辟新的途径和方法。所以实验将间充质干细胞来源的小细胞外囊泡联合视网膜祖细胞治疗RCS大鼠(一种遗传性视网膜变性模型)。结果发现,间充质干细胞来源的小细胞外囊泡联合视网膜祖细胞移植可显著改善大鼠视功能。与单独视网膜祖细胞移植相比,将间充质干细胞来源的小细胞外囊泡作为干细胞移植佐剂可促进外源视网膜祖细胞的存活、迁移和分化的数量;同时抑制视网膜小胶质细胞活化,促进移植的视网膜祖细胞细胞迁移到内核层,并分化成光感受器和双极细胞。结果提示,间充质干细胞来源的小细胞外囊泡可通过促进移植的视网膜祖细胞的存活和分化促进后者对视网膜变性的治疗效果。
https://orcid.org/0009-0008-6594-8026 (Fang Chen); https://orcid.org/0000-0002-0729-1555 (Baishijiao Bian);
https://orcid.org/0000-0003-1254-1026 (Yong Liu); https://orcid.org/0009-0006-5637-7028 (Chunge Ren);
https://orcid.org/0009-0000-5581-4560 (Min Chen); https://orcid.org/0009-0005-8412-5525 (Bangqi Ren);
https://orcid.org/0009-0002-1819-8935 (Yuxiao Zeng); https://orcid.org/0000-0002-9930-0606 (Qiang Tan);
https://orcid.org/0000-0002-9355-2319 (Qiyou Li); https://orcid.org/0000-0001-5680-9982 (Xue Zhang);
https://orcid.org/0000-0003-4119-6305 (Yajie Fang); https://orcid.org/0009-0006-4597-4919 (Yixiao Zhou);
https://orcid.org/0009-0009-5247-1051 (Weitao Zhang)