NRR:中国南通大学顾晓松团队报道转化生长因子β相关蛋白激活素A和血管生成素2促进老年受损背根神经节神经元的轴突再生
背根神经节神经元内在再生能力关乎轴突生长与神经再生。高等哺乳动物出生后轴突生长能力随年龄增长而减弱,影响再生效果。探索不同年龄段哺乳动物神经系统中的遗传背景,有助于识别对轴突生长和再生至关重要的因素。有研究发现,编码生长因子的基因在坐骨神经损伤后的不同年龄段的小鼠中表现出不同的表达模式。脑源性神经营养因子不仅在年轻小鼠受伤背根神经节中表达上调,且在老年小鼠受伤背根神经节中也表现出更高的表达水平 [1]。脑源性神经营养因子的升高有助于神经元的存活以及轴突再生 [2]。然而,一些其他生长因子的编码基因,如与转化生长因子β相关的蛋白质激活素A(Activin A, Inhba)和血管生成素2(Angiopoietin 2, Angpt2)的编码基因,在年轻动物中发生变化,但在老年动物中则未受影响 [1]。已知某些生长因子可以促进再生,但其在老年个体中的作用及潜在治疗应用尚需深入探讨。
中国南通大学神经再生重点实验室顾晓松团队在《中国神经再生研究(英文)》(Neural Regeneration
Research)上发表了题为"Transforming
growth factor beta-related proteins promote axonal regeneration of injured
dorsal root ganglion neurons"的研究。实验通过建立体外神经元培养和体内损伤模型,证明了与转化生长因子β相关的激活素A和血管生成素2这2种蛋白对轴突生长和神经再生具有促进作用,并且这种促进作用在8周龄的年轻大鼠和10月龄老年大鼠中均有效果,表明即使在老年阶段,神经元仍保有一定的再生潜力。激活素A可通过上调细胞骨架相关基因Gper1的表达来增强神经元的内在生长能力,而血管生成素2则通过调控转录因子 E2F2 的表达量来促进轴突再生。这些结果扩展了对转化生长因子β家族成员生物功能的理解,并提示其他转化生长因子β超家族成员以及转化生长因子β相关生长因子也可能促进轴突生长。
坐骨神经损伤后通过对年轻及老年小鼠受伤的背根神经节中差异表达基因的分析,筛选出编码生长因子的差异表达基因,发现部分生长因子编码基因在两类小鼠受伤的背根神经节中有相似表达趋势,但像激活素A和血管生成素2等更多生长因子编码基因仅在年轻或老年小鼠中差异表达。大鼠背根神经节测序数据显示,与对照组相比,大鼠坐骨神经损伤1d后,激活素A和血管生成素2表达升高,且在后续时间点仍保持较高水平表达(图1)。
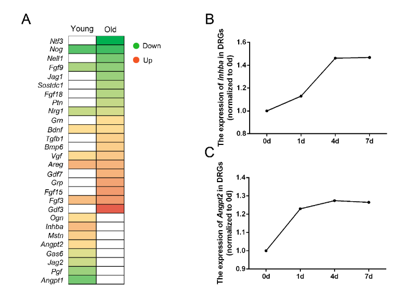
图1 坐骨神经损伤后成年和老年大鼠背根神经节中差异表达的转化生长因子β相关基因激活素A和血管生成素2的鉴定
顾晓松等分离了新生大鼠的背根神经节外植体,用含重组激活素A或血管生成素2的蛋白进行处理,固定后用神经元标记物Tuj1染色。结果显示,激活素A蛋白处理后,从背根神经节胞体长出并延伸的神经突数量和长度(相较于牛血清白蛋白对照组),明显增加。同样血管生成素2蛋白处理背根神经节外植体后,也促进了神经突的生长(图2)。
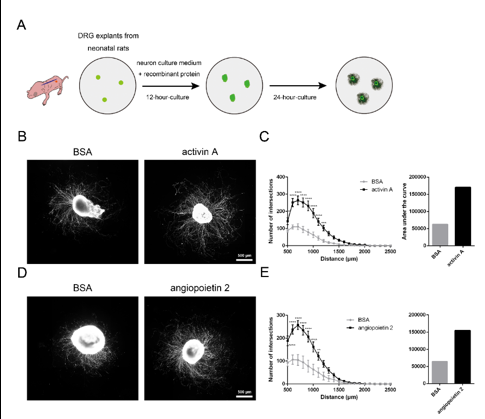
图2 激活素A或血管生成素2蛋白促进背根神经节外植体中神经突的生长
在对培养的新生大鼠背根神经节神经元进行处理后,激活素A显著增加神经元最长神经突长度和总神经突长度,血管生成素2同样使最长神经突长度和总神经突长度增加。在体外轴突离断模型中,新生大鼠背根神经节神经元在神经损伤后有一定再生能力,而加入激活素A蛋白或血管生成素2蛋白后,能促进轴突再生(图3)。
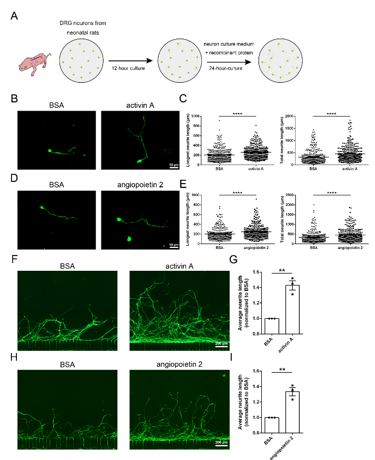
图3 激活素A和血管生成素2促进新生大鼠背根神经节神经元轴突的生长与再生
将培养的成年大鼠背根神经节神经元用激活素A和血管生成素2进行处理,发现这2种蛋白都能增加神经元最长神经突和总神经突的长度。在体外轴突离断模型中,牛血清白蛋白对照组的成年大鼠背根神经节神经元再生能力相较于新生大鼠减弱,但经激活素A或血管生成素2处理后,轴突再生长的能力显著增强。这意味着激活素A和血管生成素2能够激发成年神经元的轴突生长潜力。结果表明激活素A和血管生成素2对于不同年龄段的神经元轴突生长和再生都有着积极的促进效果,体现了其作用的普遍性(图4)。
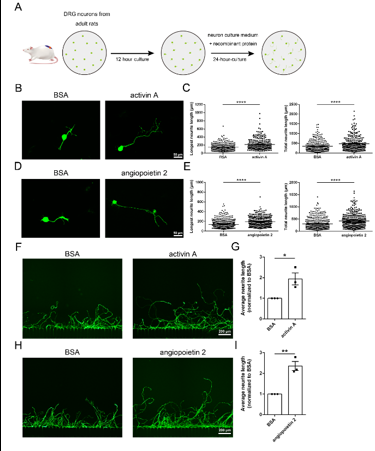
图4 激活素A和血管生成素2促进成年大鼠背根神经节神经元轴突的生长与再生
坐骨神经损伤后,在8周龄的成年大鼠的L4和L5的背根神经节中,原位注射激活素A和血管生成素2。通过比较坐骨神经挤压伤3d后SCG10阳性再生感觉轴突的长度来评估它们在体内的作用。结果表明在年轻大鼠体内,激活素A和血管生成素2这两种蛋白能有效促进坐骨神经损伤后的轴突再生(图5)。
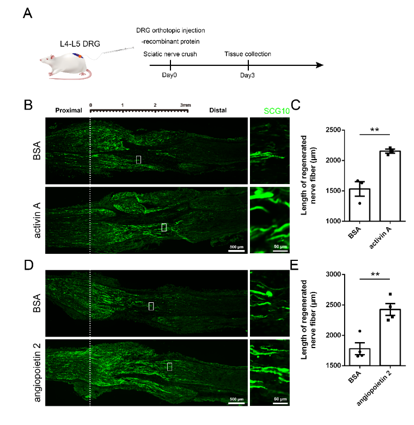
图5 激活素A和血管生成素2促进成年大鼠坐骨神经损伤后轴突的再生
坐骨神经损伤后,在10月龄的老年大鼠的L4和L5的背根神经节中,原位注射激活素A和血管生成素2。结果发现激活素A和血管生成素2促进了老年大鼠受损神经的再生。结合之前在年轻大鼠的研究结果以及体外实验中的相关发现,共同揭示了激活素A和血管生成素2在轴突再生方面的增强作用,并且说明在老年阶段,它们依旧能够促进坐骨神经损伤后的神经再生(图6)。
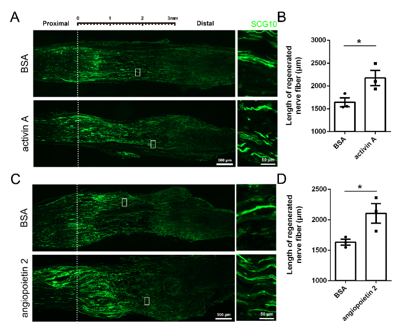
图6 激活素A和血管生成素2促进老年大鼠坐骨神经损伤后轴突的再生
围绕激活素A促进轴突再生的分子机制展开,通过对培养的年轻大鼠背根神经节神经元经激活素A蛋白后进行RNA测序,分析基因表达谱。这些差异表达基因主要涉及基因本体(GO)细胞组分,特别是与细胞骨架相关。经验证细胞骨架相关基因Gper1的表达在激活素A处理后显著上调。KEGG富集分析显示激活素A介导了背根神经节神经元中信号分子的激活和信号转导,如环磷酸腺苷(cAMP)信号通路和神经活性配体-受体相互作用。此外,检测发现激活素A处理后神经元中细胞外信号调节激酶1/2(ERK1/2)的磷酸化水平上调,其磷酸化与总量的比值升高约1.25倍,表明ERK信号在激活素A处理后被激活,揭示了激活素A通过调节相关基因表达及激活特定信号通路来促进轴突再生的内在分子机制(图7)。
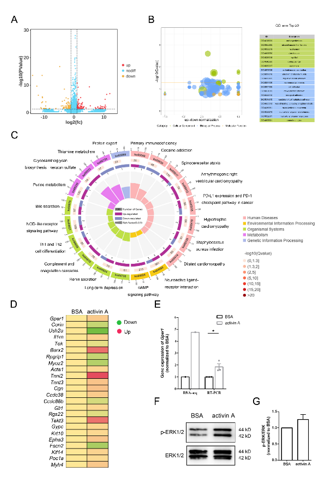
图7 激活素A调控背根神经节神经元中轴突骨架相关基因
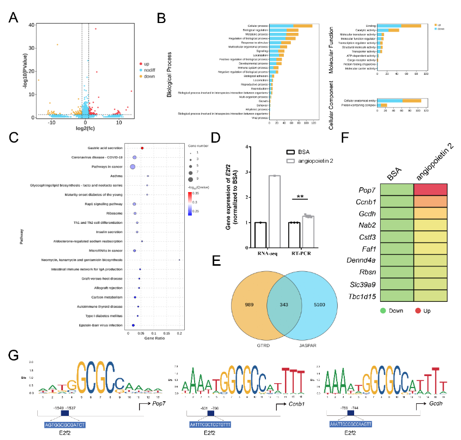
成年大鼠背根神经节神经元经血管生成素2处理后,进行RNA测序分析。GO功能分类发现这些差异表达基因主要涉及GO生物学过程,特别是细胞过程、生物调节和代谢过程。KEGG分析显示许多疾病相关信号通路富集,尤其是癌症通路。其中,包括E2f2 在内的9个与癌症通路相关的候选基因在血管生成素2处理后呈现不同表达模式,验证发现E2f2基因的表达在血管生成素2处理后升高。通过对转录因子 E2F2 潜在靶基因的筛选预测出343个候选靶点,其中10种基因与E2f2有相似表达趋势且在血管生成素2处理后上调,还分析了E2F2可能结合下游靶点启动子区域的特定位点来调控其表达,从而揭示了血管生成素2促进轴突再生的分子调控机制路径(图8)。
#br#
图8 血管生成素2调控背根神经节神经元中与癌症通路相关的基因
比年轻与老年动物受伤后的遗传变化,揭示激活素A和血管生成素2在促进背根神经节神经元轴突再生的重要作用。年轻动物受伤的背根神经节中这两种蛋白表达升高,老年动物中无显著变化,或能解释年龄增长致神经元再生能力减弱。本研究还揭示激活素A和血管生成素2在体外、体内模型中对轴突生长与神经再生的促进作用,并且证明在年轻和老年大鼠中均能提升轴突生长能力,提示老年大鼠背根神经节的神经元仍有再生潜力。
当然该研究也存在一定的局限性。一是未涵盖如20个月大的老年动物模型,限制了对非常老化个体中生长因子作用的理解;二是激活素A和血管生成素2虽都促轴突再生,但诱导的基因变化涉及不同功能分类,作用机制不完全相同,前者影响细胞骨架相关基因表达,后者上调转录因子E2F2的编码基因E2f2,具体分子机制细节还需深入探讨,尤其不同年龄段间的差异。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-01427
参考文献
[1] Zhou L, Kong G, Palmisano I, et al. Reversible CD8 T cell-neuron cross-talk causes aging-dependent neuronal regenerative decline. Science. 2022;376(6594):eabd5926.
[2] Zeng J, Xie Z, Chen L, et al. Rosmarinic acid alleviate CORT-induced depressive-like behavior by promoting neurogenesis and regulating BDNF/TrkB/PI3K signaling axis. Biomed Pharmacother. 2024;170:115994.







 #br#
#br#