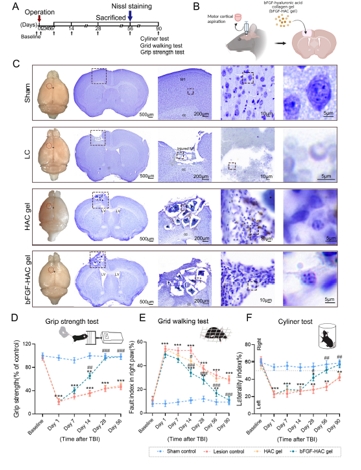
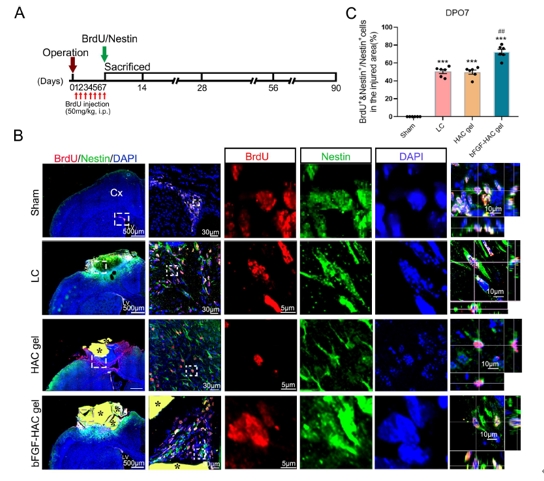
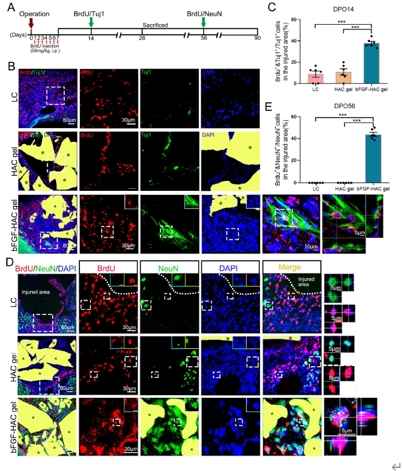
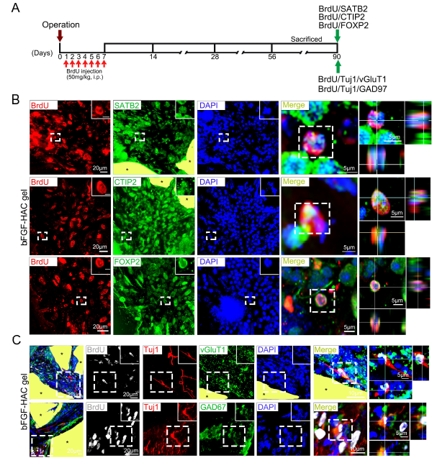
中国神经再生研究(英文版) ›› 2025, Vol. 20 ›› Issue (10): 2923-2937.doi: 10.4103/NRR.NRR-D-23-01706
碱性成纤维细胞生长因子-透明质酸胶原凝胶可激活成年内源性神经发生促进损伤大脑皮质重塑和功能恢复
Activation of adult endogenous neurogenesis by a hyaluronic acid collagen gel containing basic fibroblast growth factor promotes remodeling and functional recovery of the injured cerebral cortex
Yan Li1, 2, 3, Peng Hao1 , Hongmei Duan1 , Fei Hao4 , Wen Zhao1 , Yudan Gao1 , Zhaoyang Yang1, *, Kwok-Fai So5, 6, 7, 8, 9, *, Xiaoguang Li1, 10, *
- 1 Department of Neurobiology, School of Basic Medical Sciences, Capital Medical University, Beijing, China; 2 China Rehabilitation Science Institute, China Rehabilitation Research Center, Beijing Key Laboratory of Neural Injury and Rehabilitation, Beijing, China; 3 Center of Neural Injury and Repair, Beijing Institute for Brain Disorders, Beijing, China; 4 Beijing Key Laboratory for Biomaterials and Neural Regeneration, School of Engineering Medicine, Beihang University, Beijing, China; 5 Guangdong–HongKong–Macau Institute of CNS Regeneration, Ministry of Education CNS Regeneration Collaborative Joint Laboratory, Jinan University, Guangzhou, Guangdong Province, China; 6 Bioland Laboratory (Guangzhou Regenerative Medicine and Health Guangdong Laboratory), Guangzhou, Guangdong Province, China; 7 Department of Ophthalmology and State Key Laboratory of Brain and Cognitive Sciences, The University of Hong Kong, Hong Kong Special Administration Region, China; 8 Center for Brain Science and Brain-Inspired Intelligence, Guangdong–HongKong–Macao Greater Bay Area, Guangzhou, Guangdong Province, China; 9 Co-innovation Center of Neuroregeneration, Nantong University, Nantong, Jiangsu Province, China; 10Department of Biomedical Engineering, School of Biological Science and Medical Engineering, Beihang University, Beijing, China
摘要:
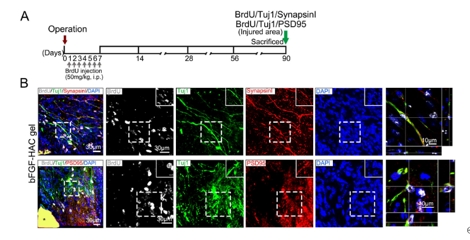
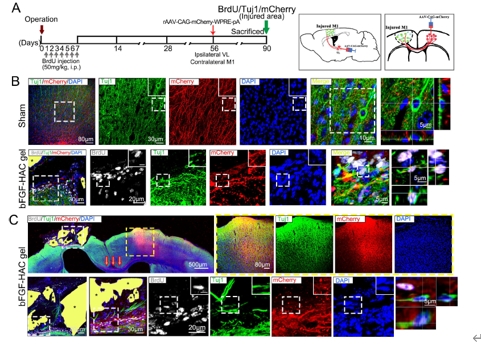
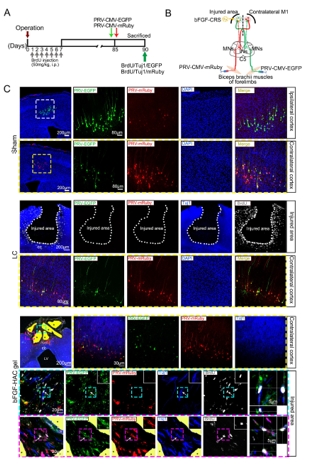
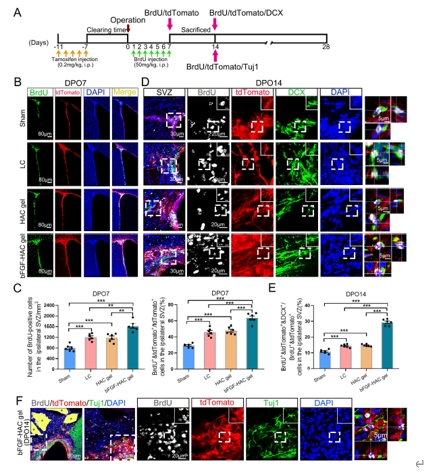
成年哺乳动物大脑中内源性神经干/祖细胞的存在被认为是中枢神经系统修复和再生的希望。然而,在皮质等非神经源性区域损伤后,能否激活神经发生和重塑皮质,并最终恢复其功能尚未可知。此次实验是在创伤性运动皮质损伤后立即将负载碱性成纤维细胞生长因子的透明质酸-胶原凝胶植入损伤区域。结果显示,碱性成纤维细胞生长因子-透明质酸胶原凝胶可激活成年大脑中的内源性神经干/祖细胞增殖、迁移和分化为成熟的功能神经元,并重建皮质的II-VI层的结构。最终,这些新生神经元可被整合到现有的神经回路中,从而改善了大脑功能。以上发现表明,碱性成纤维细胞生长因子-透明质酸胶原凝胶可为创伤性大脑皮质损伤的临床治疗提供帮助。
https://orcid.org/0000-0001-8313-6998 (Zhaoyang Yang); https://orcid.org/0000-0003-4039-4246 (Kwok-Fai So);
https://orcid.org/0000-0003-4480-3676 (Xiaoguang Li)