NRR:中南大学湘雅二医院彭伟军团队揭示外周器官代谢与肠道菌群在阿尔茨海默病发展中的作用
撰文:李宏丽
阿尔茨海默病是一种以淀粉样β蛋白积累、神经纤维缠结形成和神经炎症为特征的神经退行性疾病。尽管阿尔茨海默病的研究已取得一定进展,其主要病因和机制仍然不完全明了。近期研究表明,阿尔茨海默病不仅局限于大脑,还涉及多器官的代谢功能紊乱和病理过程,暗示了这是一种系统性疾病,涉及大脑与外周器官的双向交流[1, 2]。
肠道微生物群与宿主健康及疾病状态之间存在着复杂的相互作用。阿尔茨海默病与肠道微生物群之间的双向关系近年来成为研究热点,研究指出,肠道菌群失调可能通过促进淀粉样β蛋白聚集、触发神经炎症和氧化应激等途径加剧阿尔茨海默病病理[3, 4]。基于这些洞见,中国中南大学湘雅二医院彭伟军团队假设肠道微生物群与外周系统之间的交互可能在阿尔茨海默病的发生和发展中起到关键作用。因此,此次实验深入分析了阿尔茨海默病发展过程中的系统性变化,揭示了外周器官代谢与肠道微生物群变化之间的紧密联系,为开发针对阿尔茨海默病的新疗法提供了可能的新方向。
最近,彭伟军等在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Longitudinal assessment of peripheral organ metabolism and the gut microbiota in an APP/PS1 transgenic mouse model of Alzheimer’s disease”的研究,通过对不同月龄APP/PS1转基因小鼠和对照组小鼠进行综合分析发现,与年龄相关的代谢紊乱和肠道微生物组成的变化在阿尔茨海默病的发展中起着关键作用,特别是肾脏代谢与肠道菌群之间显示出强烈的相关性。这项研究为理解阿尔茨海默病的系统性特征及其与外周器官和肠道微生物群相互作用的复杂网络提供了新的视角。
阿尔茨海默病是一种影响全球数百万人的神经退行性疾病。随着全球人口老龄化,阿尔茨海默病的患病率预计将进一步上升。尽管阿尔茨海默病的研究已取得一定进展,但其复杂的病理机制仍然不完全清楚,尤其是阿尔茨海默病如何影响身体各个系统,包括外周器官和肠道微生物群。彭伟军等旨在探讨阿尔茨海默病的系统性影响,特别是外周器官代谢变化、肠道微生物群组成变化与阿尔茨海默病发展之间的关联。因此首先采用Morris水迷宫测试评估了APP/PS1转基因小鼠和对照小鼠的空间学习和记忆能力。同时,通过苏木精-伊红染色观察了这些小鼠大脑的组织病理改变。此外,还进行了涉及肝脏、心脏、脾脏、肺、肾以及粪便样本的代谢组学分析,并通过16S rRNA测序评估了肠道菌群的多样性和组成。在Morris水迷宫测试中,12个月龄的APP/PS1小鼠与同龄的对照小鼠相比,展现出显著的认知障碍,具体表现为较长的逃逸潜伏期、在目标象限中花费的时间较短,以及较少的平台穿越次数。此外,12个月龄的APP/PS1小鼠的大脑组织通过苏木精-伊红染色观察到了显著的病理学变化,如结构紊乱、充血、核丢失和萎缩以及细胞萎缩(图1)。
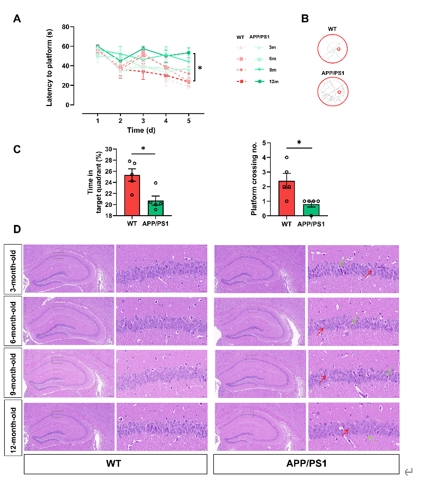
图1阿尔茨海默病表型的评估揭示了年龄增长导致的APP/PS1小鼠认知功能下降和大脑组织病理学损伤加剧(图源: Li et al., Neural Regen Res, 2025)
彭伟军等通过对肾、肝、脾、心、肺等器官以及粪便样本的代谢组分析,发现年龄和阿尔茨海默病病理进展对APP/PS1小鼠的代谢轮廓有显著影响。特别是在肾脏代谢组分析中,与同龄的野生型小鼠相比,所有年龄组的APP/PS1小鼠均显示出明显的代谢轮廓差异(图2)。

图2年龄影响下的野生型与APP/PS1小鼠肾脏代谢差异揭示阿尔茨海默病进程中的系统性代谢变化(图源:Li et al., Neural Regen Res, 2025)
代谢组分析揭示了与阿尔茨海默病进展和年龄相关的关键代谢物的变化。16s rRNA测序结果显示,与对照小鼠相比,APP/PS1小鼠的肠道微生物群展现出显著的β多样性差异。特别是,与阿尔茨海默病进展相关的肠道微生物群变化与关键器官代谢物之间存在显著相关性,暗示肠道微生物群与宿主代谢之间的复杂互动可能在阿尔茨海默病发展中发挥重要作用(图3)。

图3不同年龄下APP/PS1与野生型小鼠间肠道微生物组成差异指向肠-脑轴在阿尔茨海默病中的潜在作用(图源: Li et al., Neural Regen Res, 2025)
彭伟军等的研究强调了阿尔茨海默病作为系统性疾病的复杂性,揭示了年龄依赖性认知功能的变化、广泛的系统性代谢变化以及肠道微生物组成的动态演变与阿尔茨海默病发展的密切相关性(图4)。特别地,肾脏和肠道微生物组之间的强相关性突出了肠-肾轴在阿尔茨海默病病理中的潜在作用。这些发现不仅为理解阿尔茨海默病的系统性特征提供了新的视角,也为开发新的治疗策略提供了潜在的靶点。未来的研究可以进一步探索肠-脑轴在阿尔茨海默病中的作用,以及如何通过调节肠道微生物组成或代谢轮廓来影响阿尔茨海默病的发展。此外,识别具有潜在治疗价值的特定微生物或代谢物也是未来研究的重要方向。

图4大脑、外周器官与肠道微生物间复杂的交互作用(图源:Li et al., Neural Regen Res, 2025)
彭伟军等综合考察了阿尔茨海默病的年龄相关性认知障碍、中枢神经系统与外周器官的相互影响、以及肠道微生物群组变化,提供了关于阿尔茨海默病作为一种系统性疾病的新见解。特别地发现了外周器官代谢障碍与肠道微生物组成的显著变化,这些都与阿尔茨海默病进程紧密相关。这些发现不仅加深了对阿尔茨海默病病理复杂性的理解,也为开发新的治疗策略提供了可能的方向。然而,尽管此次研究揭示了多个有趣的联系和潜在机制,但也存在一些局限性。首先此次研究主要基于APP/PS1转基因小鼠模型,未来的研究需要在临床样本中进一步验证这些发现。其次,虽然观察到了肠道微生物组成的变化,但如何精确地将这些变化与阿尔茨海默病的特定病理特征联系起来仍需深入研究。展望未来,重要的研究方向将包括进一步探索外周器官代谢障碍与中枢神经系统退行性变化之间的确切联系,特别是如何通过调节外周代谢或肠道微生物群来减缓或逆转阿尔茨海默病的进程。此外,开发针对特定代谢途径或微生物群落的干预措施,可能会为阿尔茨海默病患者提供新的治疗选项。综上所述,此次研究强调了在阿尔茨海默病研究中考虑系统性变化的重要性,同时也指出了当前理解中的一些重要空白和未来研究的方向。通过深入挖掘阿尔茨海默病的系统性病理学,有望为这一复杂疾病的预防和治疗开辟新的途径。
原文链接:https://doi.org/10.4103/NRR.NRR-D-23-01979
参考文献
[1] Petr MA, Alfaras I, Krawcyzk M, et al. A cross-sectional study of functional and metabolic changes during aging through the lifespan in male mice. Elife. 2021;10:e62952.
[2] Tian DY, Cheng Y, Zhuang ZQ, et al. Physiological clearance of amyloid-beta by the kidney and its therapeutic potential for Alzheimer's disease. Mol Psychiatry. 2021;26(10):6074-6082.
[3] Wang Y, An Y, Ma W, et al. 27-Hydroxycholesterol contributes to cognitive deficits in APP/PS1 transgenic mice through microbiota dysbiosis and intestinal barrier dysfunction. J Neuroinflammation. 2020;17(1):199.
[4] Labus JS, Hollister EB, Jacobs J, et al. Differences in gut microbial composition correlate with regional brain volumes in irritable bowel syndrome. Microbiome. 2017;5(1):49.



