中国神经再生研究(英文版) ›› 2025, Vol. 20 ›› Issue (11): 3095-3112.doi: 10.4103/NRR.NRR-D-24-00607
探索肠道微生物群和环腺苷酸-蛋白激酶A信号通路互作:一种潜在的神经退行性疾病治疗方法
-
出版日期:2025-11-15发布日期:2025-02-22
Exploring the interaction between the gut microbiota and cyclic adenosine monophosphate-protein kinase A signaling pathway: a potential therapeutic approach for neurodegenerative diseases
Fengcheng Deng1 , Dan Yang1 , Lingxi Qing1 , Yifei Chen1 , Jilian Zou1 , Meiling Jia1 , Qian Wang1 , Runda Jiang1 , Lihua Huang1, 2, *
- 1 College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu, Sichuan Province, China; 2 State Key Laboratory of Southwestern Chinese Medicine Resources, Chengdu University of Traditional Chinese Medicine, Chengdu, Sichuan Province, China
-
Online:2025-11-15Published:2025-02-22 -
Contact:Lihua Huang, PhD, huanglihua@cdutcm.edu.cn. -
Supported by:This work was supported by the National Natural Science Foundation of China, No. 82003965; the Science and Technology Research Project of Sichuan Provincial Administration of Traditional Chinese Medicine, No. 2024MS167 (to LH); the Xinglin Scholar Program of Chengdu University of Traditional Chinese Medicine, No. QJRC2022033 (to LH); the Improvement Plan for the ‘Xinglin Scholar’ Scientific Research Talent Program at Chengdu University of Traditional Chinese Medicine, No. XKTD2023002 (to LH); and the 2023 National Project of the College Students’ Innovation and Entrepreneurship Training Program at Chengdu University of Traditional Chinese Medicine, No. 202310633028 (to FD).
摘要:
肠道微生物群与宿主中枢神经系统中环腺苷酸-蛋白激酶A信号通路之间的相互作用在神经系统疾病中起着重要的作用,其增强沿肠脑轴的交流。肠道微生物群可通过其代谢产物影响环腺苷酸-蛋白激酶A信号通路,继而激活迷走神经并调节免疫和神经内分泌系统。而环腺苷酸-蛋白激酶A信号通路的变化也会影响肠道微生物群的组成,从而形成微生物与宿主相互作用的动态网络。这种相互调节可延伸到神经发育、神经递质控制和行为特征,进而参与调节神经系统疾病。肠道微生物群和环腺苷酸-蛋白激酶A信号通路的协调作用可调节淀粉样蛋白β聚集、线粒体功能障碍、能量代谢异常、小胶质细胞活化、氧化应激和神经递质释放等过程,进而影响神经系统疾病的发生和发展。此次综述深入探索了肠道微生物群和环腺苷酸-蛋白激酶A信号通路之间复杂的相互作用,以及其对神经系统疾病潜在的影响。此外,最近有药理学研究发现,恢复肠道菌群和环腺苷酸-蛋白激酶A信号通路之间的平衡可能会改善神经退行性疾病和情绪障碍。这可通过饮食调整、益生菌补充剂、中草药提取物、中草药组合和创新药物等方法实现。提示可通过调节肠道菌群和环腺苷酸-蛋白激酶A信号通路为开发神经退行性疾病新的治疗方法提供帮助。
https://orcid.org/0009-0000-3872-6438 (Lihua Huang)
引用本文
. 探索肠道微生物群和环腺苷酸-蛋白激酶A信号通路互作:一种潜在的神经退行性疾病治疗方法[J]. 中国神经再生研究(英文版), 2025, 20(11): 3095-3112.
Fengcheng Deng, Dan Yang, Lingxi Qing, Yifei Chen, Jilian Zou, Meiling Jia, Qian Wang, Runda Jiang, Lihua Huang. Exploring the interaction between the gut microbiota and cyclic adenosine monophosphate-protein kinase A signaling pathway: a potential therapeutic approach for neurodegenerative diseases[J]. Neural Regeneration Research, 2025, 20(11): 3095-3112.
| [1] | . 多巴胺能系统与阿尔茨海默病[J]. 中国神经再生研究(英文版), 2025, 20(9): 2495-2512. |
| [2] | . 创伤性脑损伤后脑-肠-微生物轴的双向调节[J]. 中国神经再生研究(英文版), 2025, 20(8): 2153-2168. |
| [3] | . 调控cGAS-STING-干扰素调节因子 7通路对帕金森病神经炎症的影响[J]. 中国神经再生研究(英文版), 2025, 20(8): 2361-2372. |
| [4] | . 从口腔微生物视角解读脑衰老[J]. 中国神经再生研究(英文版), 2025, 20(7): 1930-1943. |
| [5] | . m6A修饰在神经干细胞、记忆和神经退行性疾病中的复杂作用[J]. 中国神经再生研究(英文版), 2025, 20(6): 1582-1598. |
| [6] | . Netrin-1信号通路在神经退行性病变中的作用机制[J]. 中国神经再生研究(英文版), 2025, 20(4): 960-972. |
| [7] | . 肠道微生物-星形胶质细胞轴:衰老相关认知减退新视角[J]. 中国神经再生研究(英文版), 2025, 20(4): 990-1008. |
| [8] | . 代谢重编程:治疗脊髓损伤的新选择[J]. 中国神经再生研究(英文版), 2025, 20(4): 1042-1057. |
| [9] | . 血浆循环游离DNA完整性和相对端粒长度作为帕金森病和多系统萎缩的诊断生物标志物:横断面研究[J]. 中国神经再生研究(英文版), 2025, 20(12): 3553-3563. |
| [10] | . 工程化细胞外囊泡治疗神经系统疾病的靶向性能力[J]. 中国神经再生研究(英文版), 2025, 20(11): 3076-3094. |
| [11] | . 肠眼轴:从脑神经退行性疾病到年龄相关性黄斑变性[J]. 中国神经再生研究(英文版), 2025, 20(10): 2741-2757. |
| [12] | . 阿尔茨海默病APP/PS1转基因模型小鼠外周器官代谢和肠道微生物群的纵向评估[J]. 中国神经再生研究(英文版), 2025, 20(10): 2982-2997. |
| [13] | . 疑似神经系统疾病者血清和脑脊液的渗透压[J]. 中国神经再生研究(英文版), 2020, 15(5): 944-947. |
出版重点
《中国神经再生研究(英文版)》杂志为SCI、PubMed数据库收录的国际唯一一本专注神经再生领域研究的经同行评议的开放获取期刊,出版来自全球神经再生领域专业学者的前沿性基础研究及临床研究及转化医学、循证医学优秀的最新成果。
期刊出版来自于脑损伤与神经再生、脊髓损伤与神经再生、周围神经损伤与神经再生和神经退行性病与神经再生、神经影像与神经再生的相关研究。期刊关注神经损伤与再生过程中的轴突再生、突触生长、神经可塑性、神经修复和替代、神经移植等最新研究成果。尤其关注应用细胞治疗、基因治疗、生物因子治疗、药物治疗、手术治疗、康复治疗、物理疗法、组织工程、生物工程、生物材料、神经假体等干预性方法产生神经再生效果的相关研究。文章应清晰描述抑制神经元损伤、减轻神经元损伤的一系列变化,保护损伤神经元的过程、方法、程度与评价,突出从细胞分子水平以及分子生物学水平解释神经元损伤后以及预后再生的机制。
NRR杂志被国际重要数据库收录
科学引文索引(Science Citation Index Expanded,SCI)
美国国立医学图书馆(PubMed)
美国国立医学图书馆开放获取全文数据库(PubMed Central, PMC)
美国生物学文摘数据库(BIOSIS previews, BP)
美国《化学文摘》(Chemical Abstracts, CA)
Scopus荷兰《医学文摘库/医学文摘》(Excerpta Medica, EM)
波兰《哥伯尼索引》(Index of Copurnicus, IC)
OvidSP平台数据库
中国科学引文数据库(CSCD)
中国科技期刊数据库-统计源期刊(CSTPCD)
编委会
主编Editor-in-Chief
苏国辉院士(Kwok-fai So, Chair Professor and Head, Jessie Ho Professor in Neuroscience, Department of Anatomy, The University of Hong Kong)。
联系方式:Email: szb@nrren.org 电话:+86 138 0499 8773
编委会成员
期刊编委队伍由国际神经再生领域著名学者、中国科学院院士、香港大学苏国辉教授领导的由100多位国际神经再生优秀专家组成。共同致力于创办一本发表神经再生领域专业学术研究经同行严格评审的优秀学术期刊。
在线投稿平台
作者可以通过www.nrronline.org在线投稿。
所有的稿件都将通过该系统提交至NRR杂志电子投稿出版管理系统。
作者有不明确的问题,请访问szb@nrren.org或咨询+86 138 0499 8773。
投稿后,当论文已处于审稿或等待审稿状态时,2个月内请勿将稿件再投至他刊。
初次投稿:
投稿信:
应说明文章未一稿多投,全部作者是否对所投稿件内容知情同意,推荐2-3位小同行审稿人。
作者协议:
投稿时请注意作者协议,如同意后可继续完成投稿, 投稿成功后作者已与杂志签定了文章的相关版权。
投稿后的同行评议
期刊投稿平台应用国际最大的投稿平台Editorial Manager,投到本刊的每篇稿件都要经过3-4位小同行审稿人评审,审稿方法为国际学科小同行组成双盲审稿。所有发表在杂志的文章都将经过严格的双盲同行层层评议,审稿中注重科学性、伦理学和文章真实性的严格审查。期刊将在投稿后4周内通知作者评审意见。
根据评审意见,编辑部决定稿件返修,再审,被接受或退稿。 稿件被接受后,作者可经投稿平台以通讯作者账号随时查询稿件的出版进程。
出版时间
一般稿件被采用后3-4个月出版,优秀文章可在被采用后1-2个月内发表,有临床试验注册号的优秀临床试验文章可申请加急发表。
出版后传播
文章出版后将在EurekAlert!和EurekAlert!中文新闻平台以中英文双语形式向全世界同仁传播。EurekAlert!和EurekAlert!中文新闻平台是美国科学促进会(AAAS)主办的一项全球的科学新闻服务。美国科学促进会为世界最大的科学协会,并且是《科学》杂志的出版机构。您的文章将以最快时间推送给经严格验证的来自全球的新闻记者8000余人,包括来自国际的纽约时报、华盛顿邮报和路透社等,来自中国的中国日报、新华社、人民日报等国际主流媒体,为科学家们提供了与国际科学记者和国际学术平台直接沟通的一个快速有效的桥梁。我们将随后为您提供您新闻的网站点击情况和媒体报告情况的具体数据。
出版后的新闻传播将极大提高文章的影响力,统计同时表明发布学术新闻的文章将提高其被引率70%以上。
杂志的读者群Audience
来自全球从事神经再生、神经科学、神经解剖、神经病理、神经外科、神经内科、神经生物、神经影像、神经放射、神经康复等领域的学科专家。
特邀稿件
对特邀综述稿件的要求:
(1)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(2)全文不超过6000个单词,包括摘要,不包括参考文献,图和表格 ,出版后8-10个版面。
(3)文章写作结构:
文题:不超过 90个字母,20个单词。
摘要:非结构式, 250单词。
引言:
主体内容:
总结:
作者贡献:
利益冲突:
参考文献:采用 Journal of Neuroscience格式。
特邀述评类文章:观点、点评 、研究亮点、给编辑的信等。
特邀观点栏目文章要求:
(1)观点文章为作者对神经再生领域某一热点问题 的评论,有作者鲜明的观点和作者本人
对此科研过程的认识 和总结。
(2)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(3)全文2000- 3000单词,包括参考文献,不需要图和表格,不需要摘要,出 版后2个版面。
(4)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
特邀点评与研究亮点栏目文章 要求:
(1)点评文章为点评在本刊发表的文章,研究亮点 文章为点评国际优秀杂志近期或在线提前发表的前沿性的优秀文章。
(2)需提前向编委会提交写作大纲,通过选题后, 文章需在2个月内完成。
(3)全文2000- 3000单词,包括参考文献,不需要图和表格,不需要摘要,出 版后2个版面。
(4)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
利益冲突:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
给编辑的信栏目文章要求:
(1)给编辑的信文章为读者对本刊已发表文章的来 信反馈。
(2)全文1000- 2000单词,不包括参考文献,文章不需要摘要、图和表格,出 版后1个版面。
(3)文章写作结构:
文题:不超过 90个字母,20个单词。
主体内容:
利益冲突:
参考文献:不超过 5条,采用Journal of Neuroscience格式。
如果您需要向SCI收录期刊投稿,我们可以为您提供如下服务--
NRR:中国成都中医药大学黄立华团队探索肠道菌群和cAMP-PKA信号通路在神经系统疾病中的相互调节:一种潜在的治疗方法
撰文:邓凤成、杨丹、黄立华
神经系统疾病涵盖神经退行性疾病、情绪障碍和意识障碍等,严重威胁全球人类健康。这些疾病的发生与神经炎症、氧化应激、线粒体功能障碍及肠道微生物群失调密切相关[1, 2]。肠道微生物群(gut microbiota)是居住在人体肠道内的复杂微生物生态系统,由细菌、真菌和原生动物等多种生物构成。它们通过调节宿主的免疫反应、炎症、氧化应激和能量代谢,进而影响大脑功能与结构。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)信号通路是重要的细胞内通讯系统,可调节神经元的生长、分化,减少炎症及氧化应激反应。目前研究发现,肠道微生物群和cAMP-PKA信号通路的协调活性在调节淀粉样蛋白β(amyloid-β,Aβ)蛋白聚集、线粒体功能障碍、能量代谢异常、小胶质细胞异常活化、氧化应激及神经递质释放等病理过程中发挥重要作用,影响神经系统疾病的发生和进展。然而,这些作用机制尚未完全明了,仍需进一步研究以全面揭示其相互作用的具体机制和途径。
来自中国成都中医药大学的黄立华团队在《中国神经再生研究(英文)》(Neural Regeneration Research)上发表了题为“Exploring the interaction between the gut microbiota and cyclic adenosine monophosphate-protein kinase A signaling pathway: a potential therapeutic approach for neurodegenerative diseases”的综述。肠道菌群通过其代谢产物影响cAMP-PKA信号通路的活性,从而调节免疫和神经内分泌系统。而cAMP-PKA信号通路的变化也会影响肠道菌群的组成,形成微生物-宿主互动的动态网络。文章得出恢复肠道菌群与cAMP-PKA信号通路之间的平衡有助于改善神经退行性疾病和情绪障碍。通过饮食调整、益生菌补充、中草药提取物以及创新的药物剂型,可以有效调节这两大系统的协同作用,将为神经疾病的治疗提供新参考。
肠道菌群在维持宿主健康中扮演着至关重要的角色,通过与宿主进行复杂的营养交换建立互动关系。肠道有益菌通过促进营养物质吸收、发酵食物、合成维生素以及增强肠道屏障功能,显著提升宿主的营养吸收和代谢能力[3]。然而,当宿主免疫力降低或细菌扩散至肠道外部位时,条件致病菌可能转变为病原体,引发疾病[4, 5]。cAMP-PKA信号通路通过激素或神经递质与细胞表面受体结合,激活腺苷酸环化酶或抑制磷酸二酯酶,增加cAMP水平,并激活PKA,这一过程调节神经元的生长、分化、减少炎症及氧化应激反应(图1)。
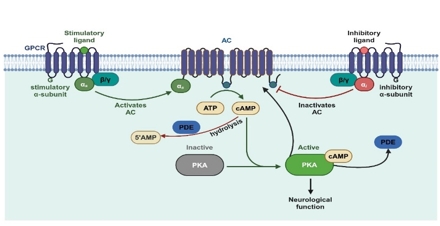
图1 cAMP - PKA信号通路概述(图源:Deng et al., Neural Regen Res, 2025)
肠道菌群与宿主中枢神经系统的cAMP-PKA信号通路通过肠脑轴系统相互调节,并在神经系统疾病中发挥作用。肠道菌群通过其代谢产物影响cAMP-PKA信号通路,激活迷走神经,调节免疫和神经内分泌系统。相反,cAMP-PKA信号通路的变化也会影响肠道菌群群的组成,形成菌群-宿主相互作用的动态网络(图2)。这种相互调节扩展到神经发育、神经递质控制和行为特征,有助于神经系统疾病的调节(图3)。
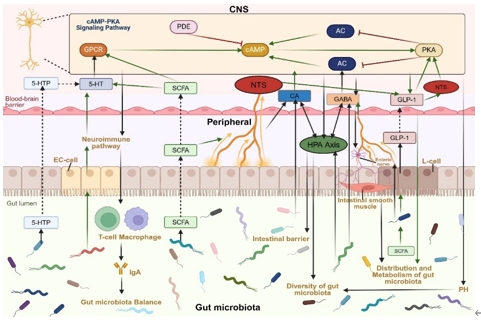
图2 肠道菌群与cAMP - PKA信号通路的相互作用(图源:Deng et al., Neural Regen Res, 2025)
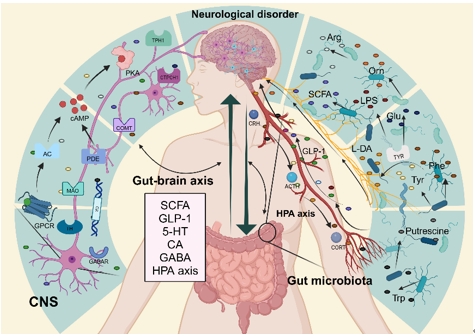
图3 神经系统疾病中肠道菌群与cAMP - PKA信号通路的相互作用机制(图源:Deng et al., Neural Regen Res, 2025)
短链脂肪酸是肠道菌群代谢产生的重要代谢产物之一,主要由双歧杆菌属、乳酸杆菌属、拟杆菌属和梭菌属等肠道细菌生成[6-8]。短链脂肪酸通过与特定受体(如GPR41,GPR43,GPR84和GPR109a)结合,介导进入cAMP-PKA信号通路[9-12],调控诸如Aβ蛋白沉积、能量代谢、神经炎症反应以及小胶质细胞活化等多种生理过程,进而改善学习记忆、认知功能及情绪障碍等。研究表明,肠道菌群产生的短链脂肪酸能显著减少阿尔茨海默病小鼠大脑中Aβ蛋白的沉积及行为障碍[13]。乳清蛋白水解物可能通过增加拟杆菌属等短链脂肪酸产生菌的丰度,调节cAMP-PKA信号通路的活性,从而显著降低Aβ蛋白的沉积,并增强中年小鼠的认知功能[14]。短链脂肪酸不仅对大脑能量供应具有重要影响,作为能量的替代来源,它们能够缓解阿尔茨海默病宿主大脑神经元功能障碍,通过激活cAMP-PKA-pCREB信号通路,促进能量摄入[15, 16]。此外,临床研究发现,帕金森病患者的粪便和血清中短链脂肪酸水平明显低于年龄相当的对照组。使用益生元干预后,可以增加如糖食链杆菌等短链脂肪酸产生菌的相对丰度,减少促炎细菌如变形菌的相对丰度,从而在一定程度上改善帕金森病患者的症状[17]。托吡酯与益生菌的联合应用,通过促进短链脂肪酸表达,减少小胶质细胞活化和炎症水平,显著改善癫痫症状[18, 19]。地衣芽孢杆菌通过提高短链脂肪酸水平,激活cAMP-PKA信号通路,参与抗炎反应,实现抗抑郁效果[20, 21]。此外,使用葡萄酒加工的五味子能上调GPR81表达,激活cAMP-PKA信号通路,有效改善小鼠的焦虑行为[22]。
胰高糖素样肽是一种由30个氨基酸组成的重要肠促胰岛素多肽,主要在远端小肠、结肠的L细胞及脑干孤束核中产生。胰高糖素样肽1的分泌可受到肠道菌群的直接或间接调控,其代谢产物通过刺激迷走神经,传递信号至孤束核,从而促进胰高糖素样肽1和胰高糖素样肽1受体的分泌[23-28]。cAMP-PKA信号通路不仅促进胰高糖素样肽1的分泌,还能改变肠道菌群的结构和代谢功能[29, 30]。胰高糖素样肽1与胰高糖素样肽1受体结合后,激活cAMP-PKA信号通路,进而介导脑部Aβ蛋白和α-突触核蛋白(α-synuclein,α-syn)的分解,促进葡萄糖代谢,调控脑部能量平衡等生理过程。这一机制与阿尔茨海默病、帕金森病及抑郁症等神经系统疾病密切相关。在葡萄糖代谢中,胰高糖素样肽1通过促进胰岛素信号转导,调节大脑中的葡萄糖代谢,从而改善阿尔茨海默病患者的认知功能和记忆障碍,补充乳酸菌可达到这一效果[31-33]。此外,胰高糖素样肽1通过cAMP-PKA信号通路抑制Aβ蛋白聚集,减少海马神经元的变性[34]。研究表明,低聚果糖通过调整APP/PS1转基因小鼠的肠道菌群结构,上调胰高糖素样肽1及其受体水平,降低大脑中Aβ蛋白的沉积[35]。补充益生菌酪酸梭菌可上调胰高糖素样肽1及其受体表达,激活cAMP-PKA信号通路,促进α-syn的分解,从而抑制机体炎症反应,发挥脑保护作用[24]。
5-羟色胺是一种关键的抑制性神经递质,由外周神经系统和中枢神经系统通过色氨酸合成[36]。尽管肠道菌群产生的5-羟色胺不能直接穿越血脑屏障,但肠道菌群可以通过分泌5-羟色胺前体和激活肠嗜铬细胞,以及调节GTP环水解酶1和5-羟色胺合成过程中的限速酶5-羟色氨酸羟化酶1的表达,从而介导5-羟色胺的信号传递和分泌[37-39]。5-羟色胺通过与其受体结合,能够促进或抑制cAMP-PKA信号通路的活性,发挥改善学习记忆、神经元保护等功能。近期研究表明,嗜酸乳杆菌益生菌可以通过上调5-羟色胺水平,改善阿尔茨海默病小鼠的线粒体功能障碍,从而减轻其学习和记忆相关的损伤[40]。此外,高色氨酸饮食和双歧杆菌婴儿亚种CCFM菌株能够逆转模型小鼠脑内5-羟色胺水平降低,进而改善癫痫和抑郁症状[41-43]。
儿茶酚胺类神经递质,包括多巴胺、肾上腺素及去甲肾上腺素,其合成起始于酪氨酸或苯丙氨酸。肠道菌群通过调控合成前体物质、关键合成酶(如酪氨酸羟化酶)以及代谢酶(如单胺氧化酶和儿茶酚-O-甲基转移酶)的活性来影响体内儿茶酚胺的水平[44-47]。肠道菌群还可分泌代谢产物,如短链脂肪酸和胰高糖素样肽1,从而促进肾上腺髓质对肾上腺素、去甲肾上腺素和多巴胺的释放,增加细胞内cAMP水平,提升机体能量供应[48-50]。此外,肠道菌群如摩根分枝杆菌和瘤胃球菌科产生神经活性化合物,通过促进或抑制多巴胺受体,间接调节cAMP-PKA信号通路的活性[51, 52]。研究表明,甘露聚糖低聚糖通过调节菌群结构,可上调去甲肾上腺素水平,减少大脑皮质、海马和杏仁核中的Aβ蛋白积累,减轻5xFAD小鼠模型中的认知和行为障碍[13]。此外,口服副干酪乳杆菌Shirota的帕金森病患者血浆中L-酪氨酸水平显著提高,非运动症状也有所缓解,而乳双歧杆菌Probio-M8则可直接增加帕金森病患者的血清多巴胺水平[53, 54]。小檗碱通过上调酪氨酸羟化酶表达,增加帕金森病小鼠体内多巴胺水平,激活cAMP-PKA信号通路,从而保护多巴胺神经元,改善帕金森病症状[55, 56]。肾上腺素和去甲肾上腺素在情绪和认知调节中起重要作用,通过与其受体结合激活cAMP-PKA信号通路,抑制神经炎症,保护神经系统,补充鼠李糖乳杆菌TF318、乳酸杆菌NS8和EC-12可减少抑郁和焦虑情绪[57-61]。
γ-氨基丁酸是中枢神经系统中的一种重要抑制性神经递质,对cAMP-PKA信号通路具有双重作用。其中,γ-氨基丁酸B受体的激活通过Gi/Go蛋白负向调节腺苷酸环化酶活性,降低cAMP产生;而γ-氨基丁酸A受体激活则通过钙离子依赖性途径激活腺苷酸环化酶,促进cAMP生成,从而调控神经细胞功能和神经递质释放[48, 62, 63]。在宿主体内,γ-氨基丁酸的来源包括谷氨酸脱羧、腐胺降解以及精氨酸或鸟氨酸降解,因此肠道菌群可以通过介导这3个来源调节宿主体内γ-氨基丁酸水平。例如,双歧杆菌属和乳酸杆菌产生谷氨酸,大肠杆菌和空肠梭菌等细菌产生腐胺,而经黏液真杆菌属调节精氨酸或鸟氨酸的代谢[64-67]。此外,肠道菌群也可通过迷走神经间接调节γ-氨基丁酸的释放,或者通过脆弱类杆菌、乳酸菌菌株和鼠李糖乳杆菌等影响神经元中γ-氨基丁酸受体的表达,从而影响宿主体内cAMP的水平[68-71]。cAMP-PKA信号通路可通过促进γ-氨基丁酸的分泌,参与肠道神经系统的信号传递,影响肠道平滑肌的活动,从而改变肠道中细菌的分布和代谢活动[72, 73]。研究显示,抑制性神经递质γ-氨基丁酸可保护神经元细胞免受氧化损伤,其在帕金森病患者大脑中的低水平可能与疾病相关,摄入戊糖片球菌可促进此过程[74-77]。肠道菌群和cAMP-PKA信号通路通过调控γ-氨基丁酸的水平、释放、信号传递等发挥脑保护作用。例如,生酮饮食和摄入益生菌如植物乳杆菌P-8,可促进γ-氨基丁酸的生成和释放,从而改善癫痫和焦虑症状[78, 79]。
下丘脑-垂体-肾上腺轴是人体内重要的神经内分泌系统,具有完善的负反馈调节机制,主要由促肾上腺皮质激素释放激素、促肾上腺皮质激素和皮质醇动态组成。一方面,皮质醇可通过激活Gαi蛋白抑制腺苷酸环化酶的活性,从而抑制cAMP的产生[80];另一方面,皮质醇可直接或间接激活磷酸二酯酶,促进cAMP的降解[81]。在动物模型中,无菌大鼠海马中糖皮质激素受体编码基因表达降低,与SPF大鼠相比,表现出更高水平的血清肾上腺皮质激素和皮质醇,表明肠道菌群的组成和代谢活动对下丘脑-垂体-肾上腺轴功能具有重要影响[82]。肠道菌群可通过其代谢物短链脂肪酸及调节γ-氨基丁酸、去甲肾上腺素和多巴胺等神经递质,调节下丘脑-垂体-肾上腺轴的表达。例如,短链脂肪酸既能通过调节小胶质细胞的功能影响宿主的神经炎症反应,从而进一步调节下丘脑-垂体-肾上腺轴的活性,又可降低编码下丘脑-垂体-肾上腺轴中涉及的蛋白质的基因的表达[83, 84]。同样,下丘脑-垂体-肾上腺轴的失衡会促进肠道中有害菌(如肠杆菌科和链球菌科)的增长,同时抑制有益菌(如双歧杆菌和粪肠球菌科)的繁殖,导致肠道菌群多样性的下降[85]。cAMP-PKA信号通路通过促进GR基因的表达和调节肾上腺皮质激素活性,维护下丘脑-垂体-肾上腺轴的正常运作,从而影响肠道菌群的平衡[86]。此外,cAMP-PKA信号通路还可通过磷酸化作用激活Ca2+通道,间接激活下丘脑-垂体-肾上腺轴。这一机制不仅增强肠道屏障完整性,还通过调节如乳酸杆菌等细菌群体的丰度,或直接作用于如幽门螺杆菌等细菌,调控肠道菌群结构[87, 88]。双歧杆菌可改善阿尔茨海默病和抑郁症患者的下丘脑-垂体-肾上腺轴功能障碍,缓解其症状[89]。此外,鼠李糖乳杆菌的应用不仅促进γ-氨基丁酸信号传导,还通过抑制过度活跃的下丘脑-垂体-肾上腺轴,减轻焦虑样行为[43, 90]。
总之,肠道菌群与cAMP-PKA信号通路的相互调节在神经系统疾病治疗中非常重要。作者的研究表明,肠道菌群与cAMP-PKA信号通路可通过短链脂肪酸、胰高糖素样肽1、5-羟色胺、儿茶酚胺、γ-氨基丁酸、下丘脑-垂体-肾上腺轴等介质相互调节,这种调节作用可介导阿尔茨海默病、帕金森病、癫痫、抑郁症和焦虑症等神经系统疾病的病程。此项研究结果将为神经系统疾病的治疗策略提供新的参考。
然而,这篇综述存在一定的局限性。首先,支持肠道菌群和cAMP-PKA信号通路共同作用于神经系统疾病的直接证据有限,尤其是cAMP-PKA信号通路调节肠道菌群结构的证据,因此需要更多的研究来进一步探索二者在神经系统疾病中联合作用的具体机制。此外,由于缺乏临床试验证据,目前尚不能明确阐明肠道菌群和cAMP-PKA信号通路在临床治疗中是否能够共同发挥作用。因此,为了提高研究的临床相关性,未来的研究应当补充临床试验证据,并考虑肠道菌群的个体差异,以确保治疗策略的个性化和有效性。
原文链接:https://doi.org/10.4103/NRR.NRR-D-24-00607
参考文献
[1] Sittipo P, Choi J, Lee S, et al. The function of gut microbiota in immune-related neurological disorders: a review. J Neuroinflammation. 2022;19(1):154.
[2] Rehman MU, Sehar N, Dar NJ, et al. Mitochondrial dysfunctions, oxidative stress and neuroinflammation as therapeutic targets for neurodegenerative diseases: An update on current advances and impediments. Neurosci Biobehav Rev. 2023;144:104961.
[3] Kolmeder CA, De Vos WM. Roadmap to functional characterization of the human intestinal microbiota in its interaction with the host. J Pharm Biomed Anal. 2021;194:113751.
[4] Fu X, Chen T, Cai J, et al. The microbiome-gut-brain axis, a potential therapeutic target for substance-related disorders. Front Microbiol. 2021;12:738401.
[5] Salosensaari A, Laitinen V, Havulinna AS, et al. Taxonomic signatures of cause-specific mortality risk in human gut microbiome. Nat Commun. 2021;12(1):2671.
[6] Unger MM, Spiegel J, Dillmann KU, et al. Short chain fatty acids and gut microbiota differ between patients with Parkinson's disease and age-matched controls. Parkinsonism Relat Disord. 2016;32:66-72.
[7] Chen C, Liu C, Zhang K, et al. The role of gut microbiota and its metabolites short-chain fatty acids in food allergy. Food Sci Hum Wellness. 2023;12(3):702-710.
[8] Wen Y, Yang L, Wang Z, et al. Blocked conversion of Lactobacillus johnsonii derived acetate to butyrate mediates copper-induced epithelial barrier damage in a pig model. Microbiome. 2023;11(1):218.
[9] Taing K, Chen L, Weng HR. Emerging roles of GPR109A in regulation of neuroinflammation in neurological diseases and pain. Neural Regen Res. 2023;18(4):763-768.
[10] Ma Y, Chen J, Yu D, et al. cAMP-PKA signaling is involved in regulation of spinal HCN channels function in diabetic neuropathic pain. Neurosci Lett. 2021;750:135763.
[11] Zhang S, Wei D, Lv S, et al. Scutellarin modulates the microbiota-gut-brain axis and improves cognitive impairment in APP/PS1 mice. J Alzheimers Dis. 2022;89(3):955-975.
[12] Nonaka H, Ohue-Kitano R, Masujima Y, et al. Dietary Medium-Chain Triglyceride Decanoate Affects Glucose Homeostasis Through GPR84-Mediated GLP-1 Secretion in Mice. Front Nutr. 2022;9:848450.
[13] Liu Q, Xi Y, Wang Q, et al. Mannan oligosaccharide attenuates cognitive and behavioral disorders in the 5xFAD Alzheimer's disease mouse model via regulating the gut microbiota-brain axis. Brain Behav Immun. 2021;95:330-343.
[14] Ding N, Meng H, Wu C, et al. Targeting brain health: Whey protein hydrolysate intervention enhances cognitive function in middle-aged mice. Food Bioscience. 2024;57:103460.
[15] Zilberter Y, Zilberter M. The vicious circle of hypometabolism in neurodegenerative diseases: ways and mechanisms of metabolic correction. J Neurosci Res. 2017;95(11):2217-2235.
[16] Bo TB, Zhang XY, Wen J, et al. The microbiota-gut-brain interaction in regulating host metabolic adaptation to cold in male Brandt's voles (Lasiopodomys brandtii). ISME J. 2019;13(12):3037-3053.
[17] Hall DA, Voigt RM, Cantu-Jungles TM, et al. An open label, non-randomized study assessing a prebiotic fiber intervention in a small cohort of Parkinson's disease participants. Nat Commun. 2023;14(1):926.
[18] Kim S, Park S, Choi TG, et al. Role of short chain fatty acids in epilepsy and potential benefits of probiotics and prebiotics: targeting "health" of epileptic patients. Nutrients. 2022;14(14):2982.
[19] Thai K, Taylor MW, Fernandes T, et al. Topiramate alters the gut microbiome to aid in its anti-seizure effect. Front Microbiol. 2023;14:1242856.
[20] Shan B, Ai Z, Zeng S, et al. Gut microbiome-derived lactate promotes to anxiety-like behaviors through GPR81 receptor-mediated lipid metabolism pathway. Psychoneuroendocrinology. 2020;117:104699.
[21] Feng S, Meng C, Liu Y, et al. Bacillus licheniformis prevents and reduces anxiety-like and depression-like behaviours. Appl Microbiol Biotechnol. 2023;107(13):4355-4368.
[22] Song Y, Shan B, Zeng S, et al. Raw and wine processed Schisandra chinensis attenuate anxiety like behavior via modulating gut microbiota and lipid metabolism pathway. J Ethnopharmacol. 2021;266:113426.
[23] Cornejo-Pareja I, Martín-Núñez GM, Roca-Rodríguez MM, et al. H. pylori eradication treatment alters gut microbiota and GLP-1 secretion in humans. J Clin Med. 2019;8(4):451.
[24] Sun J, Li H, Jin Y, et al. Probiotic Clostridium butyricum ameliorated motor deficits in a mouse model of Parkinson's disease via gut microbiota-GLP-1 pathway. Brain Behav Immun. 2021;91:703-715.
[25] Peng J, Li X, Zheng L, et al. Ban-Lan-Gen granule alleviates dextran sulfate sodium-induced chronic relapsing colitis in mice via regulating gut microbiota and restoring gut SCFA Derived-GLP-1 production. J Inflamm Res. 2022;15:1457-1470.
[26] Cheng Z, Chen J, Zhang Y, et al. In vitro hypoglycemic activities of lactobacilli and bifidobacterium strains from healthy children's sources and their effect on stimulating GLP-1 secretion in STC-1 cells. Foods. 2024;13(4):519.
[27] Manfready RA, Forsyth CB, Voigt RM, et al. Gut-brain communication in Parkinson's disease: enteroendocrine regulation by GLP-1. Curr Neurol Neurosci Rep. 2022;22(7):335-342.
[28] Salehi M, Purnell JQ. The role of glucagon-like peptide-1 in energy homeostasis. Metab Syndr Relat Disord. 2019;17(4):183-191.
[29] Tomas A, Jones B, Leech C. New insights into beta-cell GLP-1 receptor and cAMP signaling. J Mol Biol. 2020;432(5):1347-1366.
[30] Zhao L, Chen Y, Xia F, et al. A glucagon-like peptide-1 receptor agonist lowers weight by modulating the structure of gut microbiota. Front Endocrinol (Lausanne). 2018;9:233.
[31] Xie Y, Zheng J, Li S, et al. GLP-1 improves the neuronal supportive ability of astrocytes in Alzheimer's disease by regulating mitochondrial dysfunction via the cAMP/PKA pathway. Biochem Pharmacol. 2021;188:114578.
[32] Qu L, Ren J, Huang L, et al. Antidiabetic effects of Lactobacillus casei fermented yogurt through reshaping gut microbiota structure in type 2 diabetic rats. J Agric Food Chem. 2018;66(48):12696-12705.
[33] Du H, Meng X, Yao Y, et al. The mechanism and efficacy of GLP-1 receptor agonists in the treatment of Alzheimer's disease. Front Endocrinol (Lausanne). 2022;13:1033479.
[34] Batista AF, Bodart-Santos V, De Felice FG, et al. Neuroprotective actions of glucagon-like peptide-1 (GLP-1) analogues in Alzheimer's and Parkinson's diseases. CNS Drugs. 2019;33(3):209-223.
[35] Sun J, Liu S, Ling Z, et al. Fructooligosaccharides ameliorating cognitive deficits and neurodegeneration in APP/PS1 transgenic mice through modulating gut microbiota. J Agric Food Chem. 2019;67(10):3006-3017.
[36] Jones LA, Sun EW, Martin AM, et al. The ever-changing roles of serotonin. Int J Biochem Cell Biol. 2020;125:105776.
[37] Du X, Wang X, Geng M. Alzheimer's disease hypothesis and related therapies. Transl Neurodegener. 2018;7:2.
[38] Nankova BB, Agarwal R, Macfabe DF, et al. Enteric bacterial metabolites propionic and butyric acid modulate gene expression, including CREB-dependent catecholaminergic neurotransmission, in PC12 cells--possible relevance to autism spectrum disorders. PLoS One. 2014;9(8):e103740.
[39] O'mahony SM, Clarke G, Borre YE, et al. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behav Brain Res. 2015;277:32-48.
[40] Beltagy DM, Nawar NF, Mohamed TM, et al. Beneficial consequences of probiotic on mitochondrial hippocampus in Alzheimer's disease. J Complement Integr Med. 2021;18(4):761-767.
[41] Lopez ER, Carbajal AG, Tian JB, et al. Serotonin enhances depolarizing spontaneous fluctuations, excitability, and ongoing activity in isolated rat DRG neurons via 5-HT(4) receptors and cAMP-dependent mechanisms. Neuropharmacology. 2021;184:108408.
[42] Yue Q, Cai M, Xiao B, et al. A high-tryptophan diet reduces seizure-induced respiratory arrest and alters the gut microbiota in DBA/1 mice. Front Neurol. 2021;12:762323.
[43] Tian P, Zou R, Song L, et al. Ingestion of Bifidobacterium longum subspecies infantis strain CCFM687 regulated emotional behavior and the central BDNF pathway in chronic stress-induced depressive mice through reshaping the gut microbiota. Food Funct. 2019;10(11):7588-7598.
[44] Ma SR, Yu JB, Fu J, et al. Determination and application of nineteen monoamines in the gut microbiota targeting phenylalanine, tryptophan, and glutamic acid metabolic pathways. Molecules. 2021;26(5):1377.
[45] Lai F, Jiang R, Xie W, et al. Intestinal pathology and gut microbiota alterations in a methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) mouse model of Parkinson's disease. Neurochem Res. 2018;43(10):1986-1999.
[46] Grün D, Zimmer VC, Kauffmann J, et al. Impact of oral COMT-inhibitors on gut microbiota and short chain fatty acids in Parkinson's disease. Parkinsonism Relat Disord. 2020;70:20-22.
[47] Cui C, Hong H, Shi Y, et al. Vancomycin pretreatment on MPTP-induced Parkinson's disease mice exerts neuroprotection by suppressing inflammation both in brain and gut. J Neuroimmune Pharmacol. 2023;18(1-2):72-89.
[48] Gomez-Castro F, Zappettini S, Pressey JC, et al. Convergence of adenosine and GABA signaling for synapse stabilization during development. Science. 2021;374(6568):eabk2055.
[49] Lagamma EF, Hu F, Pena Cruz F, et al. Bacteria - derived short chain fatty acids restore sympathoadrenal responsiveness to hypoglycemia after antibiotic-induced gut microbiota depletion. Neurobiol Stress. 2021;15:100376.
[50] Nagliya D, Baggio Lopez T, Del Calvo G, et al. Differential modulation of catecholamine and adipokine secretion by the short chain fatty acid receptor FFAR3 and α(2)-adrenergic receptors in PC12 cells. Int J Mol Sci. 2024;25(10):5227.
[51] Jadhav KS, Peterson VL, Halfon O, et al. Gut microbiome correlates with altered striatal dopamine receptor expression in a model of compulsive alcohol seeking. Neuropharmacology. 2018;141:249-259.
[52] Chen H, Nwe PK, Yang Y, et al. A forward chemical genetic screen reveals gut microbiota metabolites that modulate host physiology. Cell. 2019;177(5):1217-1231.e1218.
[53] Yang X, He X, Xu S, et al. Effect of Lacticaseibacillus paracasei strain Shirota supplementation on clinical responses and gut microbiome in Parkinson's disease. Food Funct. 2023;14(15):6828-6839.
[54] Sun H, Zhao F, Liu Y, et al. Probiotics synergized with conventional regimen in managing Parkinson's disease. NPJ Parkinsons Dis. 2022;8(1):62.
[55] Wang Y, Tong Q, Ma SR, et al. Oral berberine improves brain dopa/dopamine levels to ameliorate Parkinson's disease by regulating gut microbiota. Signal Transduct Target Ther. 2021;6(1):77.
[56] Ismael S, Colvin RA, Lee D. Activation of cyclic AMP signaling pathway in dopaminergic neurons rescues locomotion defects in a Drosophila larval model of Parkinson's disease. Brain Res. 2024;1822:148641.
[57] Liang S, Wang T, Hu X, et al. Administration of Lactobacillus helveticus NS8 improves behavioral, cognitive, and biochemical aberrations caused by chronic restraint stress. Neuroscience. 2015;310:561-577.
[58] Nuriya M, Takeuchi M, Yasui M. Background norepinephrine primes astrocytic calcium responses to subsequent norepinephrine stimuli in the cerebral cortex. Biochem Biophys Res Commun. 2017;483(1):732-738.
[59] Chhatar S, Lal G. Role of adrenergic receptor signalling in neuroimmune communication. Curr Res Immunol. 2021;2:202-217.
[60] Zhao Y, Kang Y, Zhao Z, et al. Lacticaseibacillus rhamnosus TF318 prevents depressive behavior in rats by inhibiting HPA-axis hyperactivity and upregulating BDNF expression. Neurosci Lett. 2023;814:137460.
[61] Kambe J, Watcharin S, Makioka-Itaya Y, et al. Heat-killed Enterococcus fecalis (EC-12) supplement alters the expression of neurotransmitter receptor genes in the prefrontal cortex and alleviates anxiety-like behavior in mice. Neurosci Lett. 2020;720:134753. [62] Yan K, Gao LN, Cui YL, et al. The cyclic AMP signaling pathway: exploring targets for successful drug discovery (Review). Mol Med Rep. 2016;13(5):3715-3723.
[63] Park J, Fu Z, Frangaj A, et al. Structure of human GABA(B) receptor in an inactive state. Nature. 2020;584(7820):304-309..
[64] Mazzoli R, Pessione E. The neuro-endocrinological role of microbial glutamate and GABA signaling. Front Microbiol. 2016;7:1934.
[65] Hanfrey CC, Pearson BM, Hazeldine S, et al. Alternative spermidine biosynthetic route is critical for growth of Campylobacter jejuni and is the dominant polyamine pathway in human gut microbiota. J Biol Chem. 2011;286(50):43301-43312.
[66] Rao SN, Kumari GM, Srividya D, et al. Validation of lon gene disruption using linear DNA cassette by crelox mechanism in E. coli strains: to achieve better solubility of putrescine monooxygenase. Indian J Microbiol. 2023;63(1):56-64.
[67] Liu X, Zheng H, Lu R, et al. Intervening effects of total alkaloids of corydalis saxicola bunting on rats with antibiotic-induced gut microbiota dysbiosis based on 16S rRNA gene sequencing and untargeted metabolomics analyses. Front Microbiol. 2019;10:1151.
[68] O'leary OF, Ogbonnaya ES, Felice D, et al. The vagus nerve modulates BDNF expression and neurogenesis in the hippocampus. Eur Neuropsychopharmacol. 2018;28(2):307-316.
[69] Song C, Duan F, Ju T, et al. Eleutheroside E supplementation prevents radiation-induced cognitive impairment and activates PKA signaling via gut microbiota. Commun Biol. 2022;5(1):680.
[70] Bravo JA, Forsythe P, Chew MV, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A. 2011;108(38):16050-16055.
[71] Mao YK, Kasper DL, Wang B, et al. Bacteroides fragilis polysaccharide A is necessary and sufficient for acute activation of intestinal sensory neurons. Nat Commun. 2013;4:1465.
[72] Wang H, Sieburth D. PKA controls calcium influx into motor neurons during a rhythmic behavior. PLoS Genet. 2013;9(9):e1003831.
[73] He W, Song H, Yang Z, et al. Beneficial effect of GABA-rich fermented milk whey on nervous system and intestinal microenvironment of aging mice induced by D-galactose. Microbiol Res. 2024;278:127547.
[74] Ngo DH, Vo TS. An updated review on pharmaceutical properties of gamma-aminobutyric acid. Molecules. 2019;24(15):2678.
[75] Song Y, Gong T, Saleh MG, et al. Upper brainstem GABA levels in Parkinson's disease. MAGMA. 2021;34(5):689-696.
[76] Bian LH, Yao ZW, Wang ZY, et al. Nardosinone regulates the slc38a2 gene to alleviate Parkinson's symptoms in rats through the GABAergic synaptic and cAMP pathways. Biomed Pharmacother. 2022;153:113269.
[77] Pan S, Wei H, Yuan S, et al. Probiotic Pediococcus pentosaceus ameliorates MPTP-induced oxidative stress via regulating the gut microbiota-gut-brain axis. Front Cell Infect Microbiol. 2022;12:1022879.
[78] Jiang Y, Yang S, Tao J, et al. Opposing needling promotes behavior recovery and exerts neuroprotection via the cAMP/PKA/CREB signal transduction pathway in transient MCAO rats. Mol Med Rep. 2016;13(3):2060-2070.
[79] Lew LC, Hor YY, Yusoff NaA, et al. Probiotic Lactobacillus plantarum P8 alleviated stress and anxiety while enhancing memory and cognition in stressed adults: A randomised, double-blind, placebo-controlled study. Clin Nutr. 2019;38(5):2053-2064.
[80] Sotelo-Rivera I, Cote-Vélez A, Uribe RM, et al. Glucocorticoids curtail stimuli-induced CREB phosphorylation in TRH neurons through interaction of the glucocorticoid receptor with the catalytic subunit of protein kinase A. Endocrine. 2017;55(3):861-871.
[81] Dong T, Zhi L, Bhayana B, et al. Cortisol-induced immune suppression by a blockade of lymphocyte egress in traumatic brain injury. J Neuroinflammation. 2016;13(1):197.
[82] Crumeyrolle-Arias M, Jaglin M, Bruneau A, et al. Absence of the gut microbiota enhances anxiety-like behavior and neuroendocrine response to acute stress in rats. Psychoneuroendocrinology. 2014;42:207-217.
[83] Erny D, Hrabě De Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18(7):965-977.
[84] Van De Wouw M, Boehme M, Lyte JM, et al. Short-chain fatty acids: microbial metabolites that alleviate stress-induced brain-gut axis alterations. J Physiol. 2018;596(20):4923-4944.
[85] Jahnke JR, Roach J, Azcarate-Peril MA, et al. Maternal precarity and HPA axis functioning shape infant gut microbiota and HPA axis development in humans. PLoS One. 2021;16(5):e0251782.
[86] Kang W, Choi D, Roh J, et al. The role of cyclic adenosine monophosphate (cAMP) in modulating glucocorticoid receptor signaling and its implications on glucocorticoid-related collagen loss. Int J Mol Sci. 2023;24(12):10180.
[87] Doherty NC, Tobias A, Watson S, et al. The effect of the human gut-signalling hormone, norepinephrine, on the growth of the gastric pathogen Helicobacter pylori. Helicobacter. 2009;14(3):223-230.
[88] Bartley A, Yang T, Arocha R, et al. Increased abundance of lactobacillales in the colon of beta-adrenergic receptor knock out mouse is associated with increased gut bacterial production of short chain fatty acids and reduced IL17 expression in circulating CD4(+) immune cells. Front Physiol. 2018;9:1593.
[89] Ait-Belgnaoui A, Payard I, Rolland C, et al. Bifidobacterium longum and lactobacillus helveticus synergistically suppress stress-related visceral hypersensitivity through hypothalamic-pituitary-adrenal axis modulation. J Neurogastroenterol Motil. 2018;24(1):138-146.
[90] Tette FM, Kwofie SK, Wilson MD. Therapeutic anti-depressant potential of microbial GABA produced by Lactobacillus rhamnosus strains for GABAergic signaling restoration and inhibition of addiction-induced HPA axis hyperactivity. Curr Issues Mol Biol. 2022;44(4):1434-1451.
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||