中国神经再生研究(英文版) ›› 2026, Vol. 21 ›› Issue (6): 2476-2486.doi: 10.4103/NRR.NRR-D-24-00081
miR-301a敲除可延迟Wallerian变性进而抑制周围神经再生
MicroRNA-301a knockout attenuates peripheral nerve regeneration by delaying Wallerian degeneration
Lanya Fu1, 2, Xiaofang Hu1, 2, Jiawei Xu1, 2, Zhenlin Li1, 2, Jiale Cai1, 2, Xinrui Ma1, 2, Ying Zou1, 2, Ye He1, 2, Shuyi Xu1, 2, Yizhou Xu1, 2, 3, Jiaqi Zhang1, 2, Yunlun Li1, 2, Jingmin Liu1, 2, Tsz Hei Fong1, 2, Xianghai Wang1, 2, Lixin Zhu3 , Dongfeng Chen4 , Aijun Liu4 , Xiaodong Ma5 , Jiasong Guo1, 2, 3, *
- 1 Department of Histology and Embryology, Guangdong Provincial Key Laboratory of Construction and Detection in Tissue Engineering, National Demonstration Center for Experimental Education, School of Basic Medical Sciences, Southern Medical University, Guangzhou, Guangdong Province, China; 2 Key Laboratory of Mental Health of the Ministry of Education, Guangdong-Hong Kong-Macao Greater Bay Area Center for Brain Science and Brain-Inspired Intelligence, Guangdong Province Key Laboratory of Psychiatric Disorders, Guangzhou, Guangdong Province, China; 3 Department of Spine Orthopedics, Zhujiang Hospital, Southern Medical University, Guangzhou, Guangdong Province, China; 4 Research Center of Integrative Medicine, School of Basic Medical Sciences, Guangzhou University of Chinese Medicine, Guangzhou, Guangdong Province, China; 5 Key Laboratory of Brain, Cognition and Education Sciences, Ministry of Education, Guangdong Key Laboratory of Mental Health and Cognitive Science, Center for Studies of Psychological Application, Institute for Brain Research and Rehabilitation, South China Normal University, Guangzhou, Guangdong Province, China
摘要:
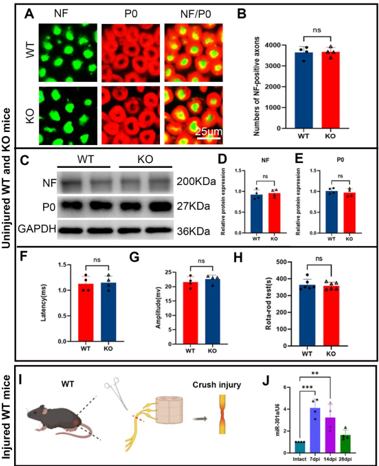
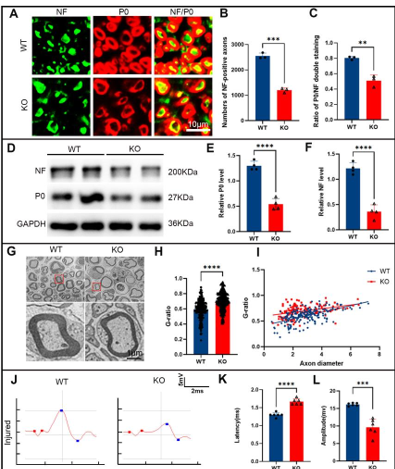
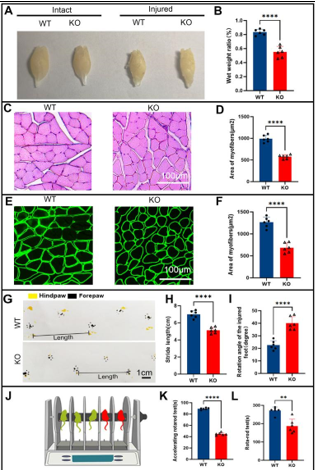
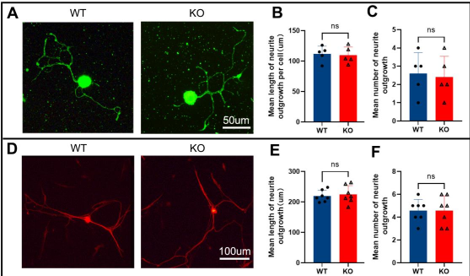
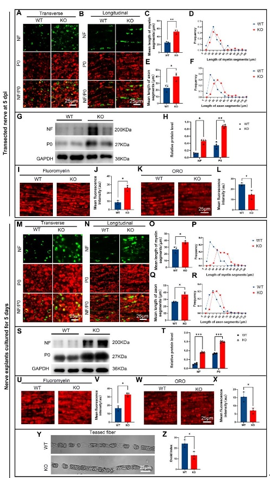
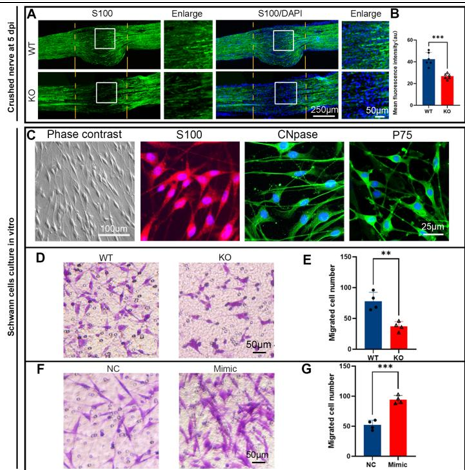
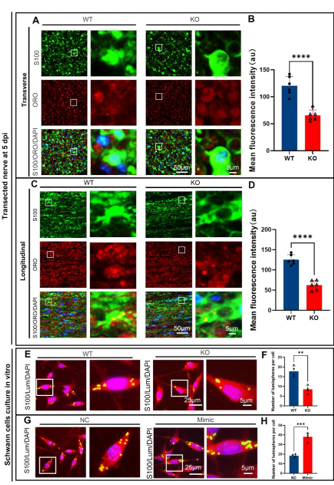
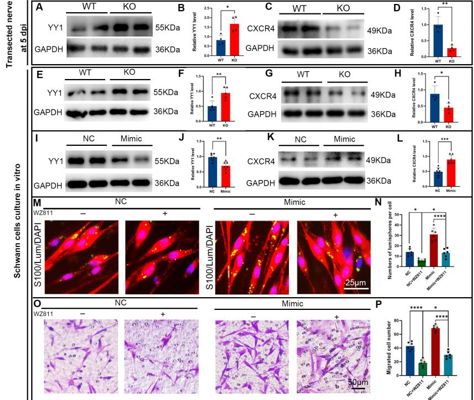
作者最近的研究一发现,miR-301a敲除可抑制巨噬细胞的迁移和吞噬作用。考虑到巨噬细胞和许旺细胞通过清除降解的轴突和髓鞘碎片协同参与Wallerian变性,而Wallerian变性是神经再生的先决条件,因而实验假设miR-301a也可能影响许旺细胞的迁移和吞噬作用,进而调节Wallerian变性和神经再生。因此,实验首先发现,miR-301a在正常神经中低表达,所以miR-301a基因敲除不会影响正常神经结构与功能,但神经损伤后,miR-301a的表达显著上调。随后实验在miR-301a敲除小鼠中建立了坐骨神经夹伤模型,发现其损伤神经的结构与功能修复能力显著减弱。实验进一步在坐骨神经横断模型和体外神经外植块模型中证实,miR-301a基因敲除能明显抑制Wallerian变性。miR-301a基因敲除可抑制许旺细胞的迁移和吞噬能力,而miR-301a敲除在许旺细胞中的作用可以通过miR-301a模拟物处理来逆转。最后通过miR-301a敲除、模拟转染和CXCR4抑制剂拯救实验对相关的分子机制进行探索,发现YY1/CXCR4通路参与了miR-301a在许旺细胞中的作用。综上得出,miR-301a可通过YY1/CXCR4通路调节许旺细胞和巨噬细胞的迁移和吞噬能力,在周围神经损伤和修复中发挥关键作用。
https://orcid.org/0000-0002-7885-2903 (Jiasong Guo)